Kemiallinen saostuminen

- 3106
- 167
- Arthur Terry II
 Sedimentaatiosäiliö vedenkäsittelyä varten
Sedimentaatiosäiliö vedenkäsittelyä varten Mikä on kemiallinen saostuminen?
Se Kemiallinen saostuminen Se on jätevedenkäsittelyprosessi, jossa kemiallisia aineita lisätään kiinteisiin hiukkasiin liuenneen epäpuhtausionien muuttamiseksi. Toisin sanoen se koostuu jäteveden sedimenttien hiukkasten tuottamisesta lisäämällä kemikaaleja.
Kemiallisen sateen päätavoite.
Vaikka suurin osa epäpuhtauksista, joita pyritään poistamaan.
Kun kiinteä kiinteä saostuu, on tarpeen suorittaa sarja vaiheita voidakseen erottaa se muusta vedestä. Nämä vaiheet sisältävät flokkulaation, sedimentaation ja kiinteän nesteen erottelun.
Liukoisuuden tasapaino ja kemiallinen saostuminen
Kemiallinen saostumistekniikka perustuu ionisten yhdisteiden liukoisuustasapainoon ja liukoisuustuotteen vakioon. Useimmissa tapauksissa saostuvat kiinteät aineet ovat vähän liukoisia hydroksideja, vaikka myös muun tyyppiset ionit ovat saostuneita.
Kaikissa kemiallisen saostumisen tapauksissa muodostettu
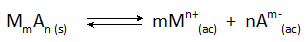
Liuokseen jäävän metallin M: n lopullinen konsentraatio määritetään tämän reaktion tasapainon vakiona, samoin kuin lisätty anionin pitoisuus, joka lisätään.
Esimerkiksi, Jos se on hydroksidi, metallin lopullinen konsentraatio riippuu hydroksidi -ionien pitoisuudesta liuoksessa ja siksi pH: sta.
Askel askeleelta kemiallinen saostumisprosessi
Kemiallinen saostumisprosessi koostuu neljästä perusvaiheesta:
Vaihe 1: Saostumisaineen lisääminen ja pH: n säätö.
Tämä on alkuvaihe, johon lisätään saostusaine (useimmissa tapauksissa se on kalsiumhydroksidi). PH säätyy sademäärän maksimoimiseksi ja veden lopullisen puhtauden optimoimiseksi.
Voi palvella sinua: Acrilonitrilo: rakenne, ominaisuudet, tuotanto, käyttötarkoituksetTämän vaiheen aikana seosta yleensä lyödään tai sekoitetaan tasaisen saostumispitoisuuden varmistamiseksi.
Vaihe 2: Floculation.
Tämä vaihe on sallia pienten kiinteiden aineiden, jotka muodostuvat sademäärän ensimmäisessä vaiheessa liittyä yhteen muodostaen hiukkasia tai "flokkeja" (siis heidän nimensä).
Nämä sedimentit nopeammin seuraavassa vaiheessa. Suosittelemaan näiden hiukkasten muodostumista rikkomatta niitä, levottomuus muuttuu hitaammin.
Vaihe 3: Sedimentaatio.
Se koostuu äskettäin käsitellyn veden seoksen antamisesta säiliössä, jotta kaikki kiinteät hiukkaset menivät taustalle (sedimentti).
Vaihe 4: Kiinteän nesteen erottaminen.
Useimmissa tapauksissa kiinteän ja nesteen erottaminen koostuu yksinkertaisesta sedimentin jääneen veden dekantoinnista. Muissa tapauksissa erotus saavutetaan suodattamalla tai jopa sentrifugoimalla käsiteltyä vettä riippuen siitä, kuinka vaaralliset epäpuhtaudet ovat.
Kemiallisen saostumisen tyypit
Hydroksidin saostuminen
Tämä on yleisin kemiallisen saostumisen tyyppi ja koostuu pH: n lisäämisestä lisäämällä alkalinen yhdiste, joka on melkein aina kalsiumhydroksidi (CA (OH)2-A.
Kemiallinen reaktio on:

Edellisessä reaktiossa M edustaa mitä tahansa metallin kationia, jota halutaan eliminoimaan. Tässä tapauksessa muodostettu kiinteä aine on hyvin pieni liukoinen hydroksidi.
Hydroksidin saostumisen tapauksessa yleinen sääntö on, että mitä suurempi OH -pitoisuus- (Mitä suurempi pH), sitä pienempi veteen jäävän metallin pitoisuus käsitelty. Toisin sanoen suuremman pH: n, veden suuremman lopullisen puhtauden suhteen.
Saostuminen sulfideilla
Tämän tyyppistä kemiallista saostumista käytetään pääasiassa raskasmetallien, kuten lyijyn tai elohopean, poistamiseen hyvin vähän liukoisten sulfidien muodossa. Tämän saavuttamiseksi sitä voidaan lisätä veteen sekä liukoisten että liukenemattomien sulfidien käsittelemiseksi.
Yleisimmin käytetyt sulfidit ovat liukoisia, jotka sisältävät rikkivety (H2S) ja natriumsulfidi (NA2S). Yleinen saostumisreaktio on:
Voi palvella sinua: seos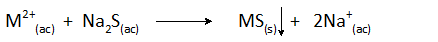
Rautasulfidia voidaan myös lisätä, mikä on liukenematonta, mutta tarjoaa riittävästi sulfidi -ioneja liuokseen suurimman osan raskasmetallien saostamiseksi.
Karbonaatin sade
Monien metallien karbonaatit ovat vähemmän liukoisia jopa hydroksidit ja voivat saostaa jätevedestä lisäämällä kalsiumkarbonaattia tai kääntämällä hydroksideja kuplivat hiilidioksidia alkalisoidussa seoksessa alkalisoidussa seoksessa.
Syanidin saostuminen
Toisin kuin aiemmissa tapauksissa, tässä pyrimme saostamaan syanidia, joka on anionin, metallin sijasta. Syanidi on erittäin vaarallinen myrkyllinen epäpuhtaus ja se voidaan poistaa jätevedestä lisäämällä sinkkisulfaattia tai rautasulfaattia, koska se muodostuu kompleksista näiden metallien kanssa, jotka saostuvat.
Kopiointi
Solmiota tapahtuu, kun liuennettu aine saostuu yhdessä toisen kanssa. Näissä tapauksissa ensimmäinen liuennin aine on kiinni kiinteässä kiinteässä kiinteissä muodossa, kun toisen yhdisteen sakka muodostuu.
Vaikuttaa siltä, että kiinteä kiinteä muodostuu ensimmäisen liuenneen aineen ja vetää sen pois liuoksesta. Tätä ilmiötä käytetään eliminoimaan joitain epäpuhtauksia, joita on vaikea saostaa.
Sovellukset
Kemiallisia sadetta käytetään loputtomissa teollisuudessa jäteveden laadun ympäristövaatimusten täyttämiseksi.
Hydroksidin saostuminen Sitä käytetään:
- Metallipintaiset
- Epäorgaaninen yhdisteiden valmistus
- Fundions
- Ilotulitusten ja räjähteiden valmistus
- Posliini -emali
- Hiilikaivostoiminta
- Lääketeollisuus muun muassa.
Toisaalta, Saostuminen sulfideilla Sitä käytetään teollisuudessa epäpuhtauksien, kuten elohopean, lyijyn ja hopean, poistamiseksi. Tällä on sovellus seuraavilla aloilla:
- Tekstiiliteollisuus
- Kaivos
- Valokuvavarusteet ja tarvikkeet
- Muiden kuin rajattomien metallien valmistus muun muassa
Näiden toimialojen lisäksi sateet ovat tärkein tekniikka Ydinreaktorien jäähdytysveden puhdistaminen. Tällä alalla sitä käytetään radioaktiivisten kationien, kuten plutoniumin, Américon, Cesion ja muiden, poistamiseen.
Kemialliset saostuvat esimerkit
Strontium -saostuminen kalsiumkarbonaatilla
Saostumisreaktio on tässä tapauksessa:
Voi palvella sinua: typpioksidit (NOX)
Reaktio suoritetaan optimaaliseen pH: han 10,5 ja saavuttaa tämän metallin pitoisuudet jopa 100 kertaa alhaisempi kuin alkuperäinen.
Antimon -hydroksidin saostuminen
Antimonin poistamiseksi jätevesistä, titaanihydroksidia voidaan käyttää saostuvan reagenssina. Reaktio on:

Tämä suoritetaan pH -alueella, joka kulkee 5: stä 8,5: een ja vähentää myös pitoisuuden arvoon 100 kertaa vähemmän kuin alku.
Cesium -saostuminen tetrafenyyliboraatilla
Tämä on erityistapaus, joka sallii cessium -saostumisen, emäksisen metallin, joka on vaikea saostua. Reaktio on:

Tetrafenyyliborarraatin käyttäminen tuo kaksi suurta hyötyä: ensin, joka toimii käytännössä mihin tahansa pH: lle (pH: sta 1: stä 13: een) ja toiseksi, että muodostettu matala suola liukoisuus mahdollistaa epäpuhtauden lopullisen pitoisuuden vähentämisen tuhannella kertoimella tuhatta.
Kuparin saostuminen natriumsulfidilla
Saostumisreaktio on tässä tapauksessa:
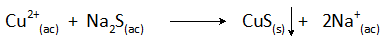
Jäteveden kuparin poisto tällä menetelmällä suoritetaan yli 8: n pH -arvoilla ja sen pitoisuus vähenee yli 99%.
Kromin, lyijyn ja sinkin kopiointi ferrihydroksidin ja alumiinihydroksidin kanssa
Tässä tapauksessa veteen lisätään natriumhydroksidia raudan ja alumiinin saostamiseksi, jota esiintyy rautahydroksidin muodossa (usko (OH)3) ja alumiinihydroksidi (Al (OH)3-A. Kun nämä kaksi hydroksidia saostuvat, ne vetävät osaa kromia, lyijyä ja sinkki -ioneja. Takkahoito rikkivetyllä poistaa melkein kaikki nämä kolme metallia.
Viitteet
- Wang, l. K -k -., Vaccari, D. -Lla., Li, ja., & Shammas, N. K -k -. (2005). Kemiallinen saostuminen. Fysiikkakemialliset hoitoprosessit, 141-197. Doi: 10.1385/1-59259-820-X: 141
- Striebig, b.-Lla. (2005). Kemiallinen saostuminen. Water Encyclopedia (toim. J -.H. Lehr ja J. Keeley). https: // doi.org/10.1002/047147844X.PC101
- Britannica, t. Toimittajat de Encyclopaedia (2018, 8. helmikuuta). Kemiallinen saostuminen. Britannica Encyclopedia. https: // www.Britannica.com/tiede/kemian saostus
- D -d. Bhattacharyya, a. B -. JUMAWAN JR. Ja r. B -. Grieves (1979) Myrkyllisten raskasmetallien erottaminen sulfidin tarkistamisella, erotustieteellä ja tekniikalla, 14: 5, 441-452, doi: 10.1080/01496397908058096
- Marina Maya Marchioretto, Harry Bruning & Wim Rulkens (2005) Raskasmetallien tarkkuus jätevesilietissä, erotustiede ja tekniikka, 40:16, 3393-3405, doi: 10: 10.1080/01496390500423748

