Le Châtelier -periaate

- 4310
- 1109
- Kelly Kilback
Mikä on Le Châtelierin periaate?
Hän Le Châtelier -periaate Se on yleinen sääntö, joka ennustaa vaikutuksen, joka kemialliseen tasapainoon vaikuttavat eri tekijät ovat. Erityisesti se auttaa ennustamaan, mihin suuntaan tasapainossa oleva reaktio liikkuu, kun ulkoinen aine häiritsee tällaista tasapainoa.
Tämä periaate osoittaa, että:
"Kun tasapainossa olevaan järjestelmään kohdistuu häiriöitä tai ulkoista jännitystä, järjestelmä reagoi suuntaan, joka antaa sen vastaamaan osittain tällaista häiriötä".
Häiriöt ymmärretään hyvin:
- Minkä tahansa reagenssin pitoisuuden muutos.
- Minkä tahansa tuotteen pitoisuuden muutos.
- Paineen muutokset.
- Tilavuuden muutokset.
- Lämpötilan muutos
Kun muutoksia tapahtuu mainitulla tavalla, toista kahdesta reaktiosta, suoraa tai käänteistä, suositaan toisiinsa nähden niin, että järjestelmä reagoi siinä mielessä siirtymässä kohti uutta tasapainotilaa kohti.
Tämä on samanlainen kuin tasapainottajan tekemät säädöt. Kun toisella puolella painovoima Hala, tasapainottaja reagoi siirtymällä vastakkaiselle puolelle. Sanomme, että hänen tasapainonsa liikkui, koska hän on edelleen tasapainossa (hän ei pudota), mutta nyt hänellä on erilainen asema.
Seuraavaksi näemme, kuinka Le Châteliser -periaatetta käytetään ennustamaan suunta, johon järjestelmä reagoi kärsimällä erityyppisiä jännitteitä tai häiriöitä, kuten: muutokset pitoisuudessa, tilavuus, paine ja lämpötila.
Pitoisuuden muutosten vaikutus
Oletetaan, että meillä on seuraava reaktio tasapainossa:
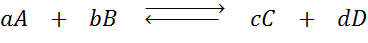
Jos muutamme minkä tahansa mukana olevan lajin (A, B, C tai D) pitoisuutta, Le Châtelierin periaate ennustaa, että järjestelmä reagoi vastaamaan tätä muutosta joko joko kuluttaen ylimääräistä lisättyä tai eliminoidun määrän palauttamista. 4 erilaista tilannetta voidaan antaa:
1. Lisääntynyt reagenssipitoisuus
Jos lisäämme reagenssin pitoisuutta esimerkiksi Le Châtelierin periaatteen mukaisesti, järjestelmä reagoi lisätyn ylimääräisen kuluttamiseen. Tämä tarkoittaa, että se reagoi suoraan (vasemmalta oikealle), koska tämä suunta kulutetaan.
Tässä tapauksessa sanotaan, että suoraa reaktiota suositaan ja että tasapaino siirtyi kohti tuotteita, koska uudessa tasapainossa tuotteiden pitoisuus on suurempi kuin alkuperäisessä tasapainossa.
Voi palvella sinua: magneettinen erotus2. Lisääntynyt tuotepitoisuus
Jos lisäämme tuotteen pitoisuutta, esimerkiksi C, järjestelmä reagoi päinvastaisesti ylimääräisen C: n kuluttamiseksi (ts. Oikeasta vasemmalle).
Tässä tapauksessa sanotaan, että käänteinen reaktio on suosittu ja että tasapaino siirtyy kohti reagensseja.
3. Reagenssipitoisuuden väheneminen
Pitoisuuden laskulla on päinvastainen vaikutus mainitun pitoisuuden lisääntymiseen. Jos vetäytymme väliaineesta, vähentäen siten sen pitoisuutta, järjestelmä reagoi vasemmalle (päinvastaiseen) muutoksen torjumiseksi. Tasapaino siirtyy kohti reagensseja.
4. Tuotteiden pitoisuuden väheneminen
Jos vähentämme C: n tai D: n pitoisuutta, järjestelmä reagoi suoraan vähentyneen pitoisuuden korvaamiseksi (ts. Vasemmalta oikealle). Tasapaino siirtyy kohti tuotteita.
Esimerkki:
Määritä tiokianaatti -ionien lisäämisen vaikutus (SCN-) Seuraavassa kemiallisessa tasapainossa tietäen, että oikean tuote on voimakas punainen ja rauta (III) on keltainen.
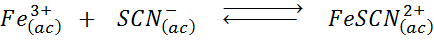
Ratkaisu: Tässä tapauksessa lisäämme Tiocianato, joka on reagenssi, joten tasapainon on siirryttävä oikealle, lisäämällä kompleksin pitoisuutta ja siten punaisen värin voimakkuutta liuoksessa.
Tilavuuden ja paineen muutosten vaikutus
Muutokset tilavuudessa ja paineessa eivät vaikuta merkittävästi nesteen tai kiinteän tilan tasapainon reaktioihin, mutta ne voivat vaikuttaa kaasumaisessa tilassa. Tämä johtuu siitä, että kaasujen pitoisuus on verrannollinen paineeseen, kuten ihanteelliset kaasulaki ennustaa.
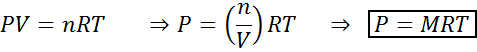
Vakiolämpötilaa ylläpitävän kaasun paineen lisääminen vastaa sen tilavuuden vähentämistä, joten molempien häiriöiden vaikutus on sama.
Jos kokonaispaine nousee tasapainon tasapainoreaktioon (tai vähennämme sen tilavuutta), järjestelmä reagoi yrittäen vähentää tällaista painetta uudelleen, joten tasapaino siirtyy siihen, missä on pienempi määrä kaasumaisia hiukkasten molekyylejä.
Voi palvella sinua: Hienokerroksen kromatografia: Ominaisuudet, mitä se on Typen ja vedyn välisessä reaktiossa ammoniakin muodostamiseksi kulutetaan 4 soodamolekyyliä ja tuotetaan vain kaksi, joten paineen nousu syrjäyttää tasapainon kohti eniten ammoniakkien muodostumista
Typen ja vedyn välisessä reaktiossa ammoniakin muodostamiseksi kulutetaan 4 soodamolekyyliä ja tuotetaan vain kaksi, joten paineen nousu syrjäyttää tasapainon kohti eniten ammoniakkien muodostumista Jos ne kulutetaan ja tuotetaan sama määrä kaasumolekyylejä, tilavuus ja paineen muutokset eivät vaikuta tasapainoon.
Toisaalta, jos muokkaamme vain minkään kaasun osittaista painetta, vaikutus on sama kuin mainittujen lajien pitoisuuden lisäämiseksi tai vähentämiseksi.
Esimerkki:
Kun otetaan huomioon dyitppitedroksidin hajoamisreaktio tasapainossa:
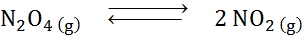
Määritä vähentävän tilavuuden, kasvavan paineen vaikutus.
Ratkaisu: Jos lisäämme järjestelmän kokonaispainetta tai vähennämme sen tilavuutta, tasapaino siirtyy kohti reagensseja, koska siihen suuntaan kaasumolekyylien väheneminen (2 ja 1) kulutetaan 1), joka mahdollistaa paineen nousun torjumiseksi.
Lämpötilan muutosten vaikutus
Lämpötilan vaikutus kemialliseen tasapainoon on erilainen kuin muut tähän mennessä nähneet tekijät. Edellisissä tapauksissa häiriöiden jälkeen saadaan uusi tasapaino, mutta sama tasapainovakio ylläpidetään. Kuitenkin, jos lämpötila muuttuu, tasapainovakio muuttuu.
Tietämään, kuinka tasapainovakio muuttuu lämpötilan kanssa, reaktion entalpian merkki on tiedettävä:
- Jos reaktio vapauttaa lämpöä, ts. Se on eksoterminen, sen entalpia on negatiivinen ja tasapainovakio laskee lämpötilan noustessa. Näissä tapauksissa tasapaino liikkuu vastakkaiseen suuntaan reagensseja kohti.
- Jos reaktio imee lämpöä, ts. Se on endoterminen, sen entalpia on positiivinen ja päinvastoin.
Lämpötilan vaikutuksen muistaminen on helppoa, jos pidämme lämpöä reagenssina, joka tapahtuu eksotermisten reaktioiden tapauksessa ja jota kulutetaan endotermisten tapauksessa. Lämpötilan nousu olisi kuin "lisää" lämpöä järjestelmään ja jäähdytä ne vastaavat sen poistamista.
Joten, jos reaktio on eksoterminen ja lämpötila nousee, se olisi kuin lisäämällä reaktion tuote, joten tasapaino liikkuu vastakkaiseen suuntaan, kohti reagensseja, ja jos se jäähtyy päinvastoin.
Se voi palvella sinua: Píchricihappo: Mikä on, rakenne, synteesi, ominaisuudetToisaalta, jos reaktio on endoterminen ja lämpötila nousee, se olisi kuin reagenssin lisääminen, joten tasapaino siirtyy kohti tuotteita, kun taas lämpötilan laskulla on päinvastainen vaikutus.
Esimerkki:
N: n hajoamisreaktio2JOMPIKUMPI4 Siinä on +58,0 kJ/mol reaktion entalpia. Mihin suuntaan tasapaino liikkuu, jos lämpötila laskee?
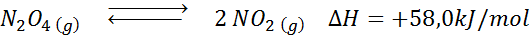
Ratkaisu: Koska entalpia on positiivista, reaktio on endoterminen. Tästä syystä jäähdytys se suosii käänteistä reaktiota, ja tasapaino siirtyy kohti reagensseja, ts2JOMPIKUMPI4.
Katalyyttien, estäjien ja inerttien aineiden vaikutus
Katalyyttit ja estäjät vaikuttavat reaktioiden nopeuteen, mutta ne vaikuttavat sekä suoraan että epäsuoraan reaktioon. Tästä syystä ne eivät vaikuta tasapainotilaan.
Toisaalta inertin aineen lisääminen kaasuksi, joka ei reagoi minkään reagenssin tai tuotteen kanssa, ei vaikuta suoraan tai suoraan reaktioon, joten sillä on mitään vaikutusta tasapainoon.
Le Châtelierin periaatteen soveltaminen
Tämän periaatteen ymmärtäminen on erittäin hyödyllistä, koska se antaa meille mahdollisuuden manipuloida reaktion tasapainotilaa mukavuutemme.
Niissä tapauksissa, joissa olemme kiinnostuneita.
Tämä tarkoittaa:
- Lisää suuria määriä reagensseja, jos nämä ovat taloudellisia.
- Vedä tuote reaktion edetessä järjestelmän ylläpitämiseksi jatkuvan jännitteen tilassa yrittäen aina saavuttaa tasapainon reagointia suoraan.
- Nosta lämpötilaa endotermisten reaktioiden tapauksessa.
- Lisää painetta niihin reaktioihin, joissa kulutetaan enemmän kaasumolekyylejä kuin ne tapahtuvat.
Saatamme myös minimoida tuotteen määrän, joka muodostuu ei -toivotulla reaktiolla. Näissä tapauksissa teemme päinvastoin.
Sovellusesimerkki Le Châtelier -periaatteesta
Orgaanisessa synteesissä Le Châtelierin periaatetta käytetään jatkuvasti reaktioiden parantamiseen.
Esimerkiksi alkoholin kuivumisreaktioissa ympäristöön lisätään kuivausaineita, jotka absorboivat reaktion aikana muodostetun veden. Tämä vähentää mainitun tuotteen pitoisuutta, joka syrjäyttää tasapainon kohti tuotteita.

