Prionit
- 1854
- 287
- Kelly Kilback
 Prionit ovat huonosti taitettuja proteiineja, jotka välittävät tämän virheellisen tiedon muille proteiineille ja aiheuttavat läpäiseviä spongiformia enkefalopatiat. Lähde: Wikimedia Commons
Prionit ovat huonosti taitettuja proteiineja, jotka välittävät tämän virheellisen tiedon muille proteiineille ja aiheuttavat läpäiseviä spongiformia enkefalopatiat. Lähde: Wikimedia Commons Mitkä ovat prionit?
Se prionit Ne ovat proteiineja ilman genomia tai nukleiinihappoja, jotka toimivat tarttuvina aineina. Niitä löytyy normaalista solukalvosta, vain huonosti taitettuina proteiineina ja/tai epänormaalilla kolmiulotteisella rakenteella.
Nämä proteiinit ovat vastuussa monista rappeutuvista sairauksista ja erittäin korkeasta kuolleisuudesta, jotka vaikuttavat hermostokudoksiin ja aivojen rakenteeseen.
Niitä kutsutaan myös prionisairauksiin. Ihmisten tärkeimpien joukossa ovat Kuru, Gerstmann-Sträussler-Scheinker -tauti, Creutzfeldt-Jakob-oireyhtymä ja kuolemaan johtanut perheen unettomuus.
Prion -ominaisuudet
- Väkiläiset ovat proteiinirakenteita, jotka ovat läsnä solukalvoissa. Näillä proteiineilla on muuttunut muoto tai konformaatio [PRP (SC)].
- Sen kertolaskennan suhteen se saavutetaan muuttamalla muodot, kuten vapisevassa taudissa. Tässä taudissa prionit rekrytoivat prp (c) (valvomattoman konformaation prioniproteiinit) stimuloidakseen muuntamista PRP: hen (SC) -isoformiin.
- Näissä epätavallisissa leviämisessä kykenevissä proteiineissa ei ole nukleiinihappoja. Todiste tästä on, että ne ovat resistenttejä x -säteilylle ja ultraviolettisäteilylle. Nämä aineet hajottavat helposti nukleiinihapot.
- Prionisia proteiineja, joista prioneja (PRP) koostuu, löytyy koko kehossa, ei vain ihmisten, vaan muiden terveiden selkärankaisten lisäksi.
- Jotkut tutkijat ovat onnistuneet osoittamaan, että hiirissä nämä proteiinit aktivoivat myeliinisen korjauksen ääreishermostokennoissa. On myös osoitettu.
Prionirakenne
Tieto prionien rakenteesta sijaitsee pääasiassa bakteereissa suoritetuissa tutkimuksissa Escherichia coli.
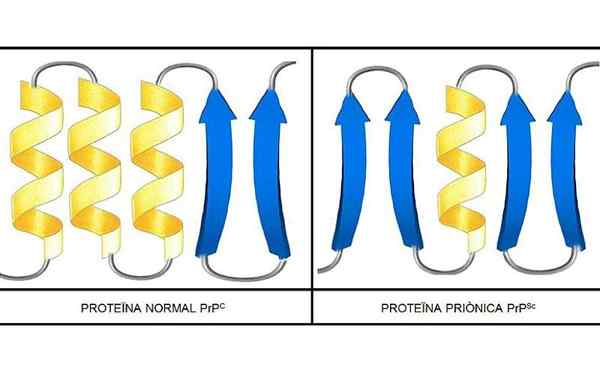
Suoritettiin tutkimukset, että ketjun PRP: n (C) (normaali) ja PRP (SC) (tarttuva) polypeptidit ovat identtisiä aminohappojen koostumuksessa, mutta eroavat 3D -konformaatiosta ja näiden laskostumisessa.
PRP (C)
Nämä ei -tarttuvat prionit läsnä, ihmisillä, 209 aminohappoa. Heillä on disulfidilinkki. Sen rakenne on alfa-helikoidinen, mikä tarkoittaa, että siinä on spiraalimuotoisia aminohappoja (alfapotkurit) ja vähän litteää aminohapposanaa (beetalehdet).
Se voi palvella sinua: biologian aputieteetTätä proteiinia ei voida erottaa sentrifugoimalla, mikä tarkoittaa, että se ei ole sedimentissä. Se sulautetaan helposti leveän spektrin laajalla proteaasilla, nimeltään proteinaasi k.
PRP (SC)
Se on tarttuva proteiini, joka muuttaa PRP (C) tarttuviksi PRP (SC) -isoformeiksi.
3D -rakenteesta tiedetään hyvin vähän, mutta tiedetään, että sillä on vähän kierteisiä muotoja ja litteämpiä säikeitä tai beetalehtiä. Muutos isomuotoon on niin kutsuttu prionisairauksien perustapahtuma.
Prion -toiminnot
Soluproteiinit [PRP (C)] sijaitsevat monenlaisten elinten ja kudosten solun pinnalla. Hyvin vähän tiedetään kehon prionien fysiologisista toiminnoista.
Silti hiirissä tehdyt kokemukset osoittavat mahdollisia toimintoja, kuten:
Metabotrooppisilla glutamaattireseptoreilla
On osoitettu, että PRP (C) toimii glutamaattireseptoreilla (ionotropiikat ja metabotrooppiset). PRP (C) osallistuu solun pinnan solupeptidin synaptotoksisten oligomeerien reseptorina.
Alkion kehityksessä
Murinae -perheen hiirissä on havaittu, että PRP (C) Prion -proteiinit ilmenevät muutama päivä implantoinnin jälkeen, alkion kehityksessä.
Tämä osoittaa, että niillä on rooli näiden pienten nisäkkäiden kehityksen aikana. Paperi, joka tutkijoiden mukaan liittyy neuritogeneesin säätelyyn (neuronien aksonien ja dendriittien tuotanto).
Ne toimivat myös aksonaalisessa kasvussa. Nämä prioniproteiinit ovat jopa mukana pikkuaivopiirin kehittämisessä. Tämän vuoksi uskotaan, että näiden prionien puuttuminen (c) edellyttää jyrsijöiden moottorin kehitystä.
Neuroprotektori
PRP: n (c) yliekspressiota koskevissa tutkimuksissa geenien suuntautumisesta johtuen havaittiin, että näiden prionien puuttuminen aiheuttaa veren kasteluongelmia tietyissä aivoissa (akuutti aivo -iskemia).
Tämä tarkoittaa, että prioniproteiinit toimivat neuroprotektoreina. Lisäksi on osoitettu, että PRP: n (c): n yliekspressio voi vähentää tai parantaa iskemian aiheuttamia vaurioita.
Perifeerinen hermosto
Äskettäin PRP: n (C) fysiologinen toiminta löydettiin perifeerisen myeliinin ylläpitämisessä.
Voi palvella sinua: Dystrofiini: Ominaisuudet, rakenne ja toiminnotLaboratoriotutkimuksen aikana havaittiin, että ilman prioniproteiinia, laboratoriohiirillä kehittyi hermovajeet, jotka siirtävät tietoa aivoista ja selkäytimestä, ns. Perifeeriseksi neuropatiaksi.
Solukuolema
On joitain prioniproteiineja, ja ne sijaitsevat muualla kehossa kuin aivoissa.
Tällaisten proteiinien tehtävänä on aloittaa, säädellä ja/tai hallita solukuolemaa, kun vartaloa hyökätään (esimerkiksi vuloneilla), mikä estää patogeenin etenemistä.
Tämä näiden proteiinien ominainen toiminta saa tutkijat ajattelemaan ei -tarttuvien prionien mahdollista merkitystä taudinaiheuttamisessa.
Pitkäaikaismuisti
Stowers -instituutissa, Missourissa, EE: ssä. Uu., Hän osoitti, että PRP -prionilla voi olla toiminto pitkän aikavälin muistin ylläpitämisessä.
Tutkimus paljasti, että tiettyjä prioniproteiineja voidaan hallita pitkäaikaisen muistin fysiologisten toimintojen ylläpitämiseksi.
Äidisolujen uusiminen
Tutkimus prioniproteiineista, jotka ekspressoituvat kantakudossoluissa, paljastivat, että kaikki nämä kantasolut (hematopoieettinen), ekspressoivat prioniproteiineja solukalvossa. Joten uskotaan osallistuvan monimutkaiseen ja erittäin tärkeään solujen uusimisprosessiin.
Prionien aiheuttamat sairaudet
Yleisimmät prionisairaudet ovat:
Creutzfeldt-Jakob (ECJ) -tauti (ECJ)
Se on ihmisten keskuudessa yleisintä prionitauti, se on kosmopoliittinen patologia, ts. Maailmanlaajuinen jakautuminen. Se voi tapahtua perintö (perhe), satunnainen tai tarttuva.
Gerstmann-Sträussler-Scheinker -tauti
Se on tauti, jonka aiheuttavat perinnöllisessä tarttuvassa tai autosomaalisessa hallitsevassa enkefalisessa prosessissa. Tauti ilmenee ihmisille 40 - 60 vuotta.
Prionopatia muuttuvalla proteaasiherkkyydellä
Se on hyvin harvinainen sairaus siihen pisteeseen, että sen esiintymisalue on 2–3 tapausta 100 miljoonaa asukasta kohti. Patologia on samanlainen kuin Gerstmann-Sträussler-Scheinker -tauti.
Tappava unettomuus
Se on perinnöllinen tai tuttu sairaus, vaikka se voi tapahtua myös satunnaisesti. Tiedetään, että tauti johtuu hallitsevasta perinnöllisestä tai autosomaalisesta mutaatiosta.
Voi palvella sinua: endeemiset lajitKuru
Tämä prionitauti on havaittu vain Papua -Uuden -Guinean asukkaille. Se on kannibalismiin liittyvä sairaus ja kuolleiden kaksintaistelu riitin kulttuuriperinteet, joissa nämä ihmiset syövät ihmisen aivoja.
Eläinten sairaudet
PRIONin tuottamien patologioiden joukossa on spongiform enkefalopatia naudan. Tämä tauti aiheutti tuhoa Euroopassa, kansanterveydessä, eläinten ja asianomaisten maiden taloudessa.
Muita eläinten sairauksia ovat scrapy, minkin tarttuva enkefalopatia, krooninen kulutustauti (hirvissä) ja kissan spongiform enkefalopatia.
Näistä sairauksista, kuten ihmisillä esitetyistä, puuttuu tehokas hoito, joten ehkäisy on olennaista, etenkin ihmisten tartunnan saaneiden lehmien lihan kulutuksen vuoksi tapahtuneiden ihmisten tartuntojen jälkeen.
Hoitoja
Tähän päivään mennessä prionisairauksien parannus. Hoito on oireenmukaista. Potilaita suositellaan suunnittelemaan palliatiivista hoitoa ja geneettistä analyysiä ja neuvoja perheenjäsenille suositellaan.
Laaja valikoima lääkkeitä on testattu potilailla, joilla on prionisairauksia, kuten viruksenvastainen, antituumorin vastainen.
Tällä hetkellä ei kuitenkaan ole todisteita, jotka osoittaisivat, että jotkut näistä vähenevät oireita tai parantavat sairaiden eloonjäämistä.
Ennaltaehkäisy
Vahvat ovat kestäviä monille fysikaalisille ja kemiallisille muutoksille. Erilaisia tekniikoita käytetään kuitenkin saastuneiden kirurgisten välineiden potilaiden pilaantumisen välttämiseksi.
Yleisimmin käytettyjen tekniikoiden joukossa on laitteiden sterilointi autoklaavessa 132 ° C: ssa tunnin ajan ja upottaa sitten instrumentit natriumhydroksidissa vähintään yhden tunnin ajan.
Toisaalta Maailman terveysjärjestö (WHO) on kehittänyt toimenpiteitä prionisairauksien leviämisen välttämiseksi. Tämä organisaatio vahvistaa säännöt kiellettyjen tai mahdollisesti riskialttiiden kudosten, kuten silmät, aivot, suolet, risat ja selkäytimen, hallintaan.
Viitteet
- Prion, tarttuva aine. Toipunut Britannicasta.com.
- Mikä on prioni? Scientificanista toipunut.com.
- Prioni. Haettu jstk.Wikipedia.org

