Adiabaattiset prosessityypit, esimerkit, harjoitukset ratkaistu
- 3642
- 656
- Louis Moen
Eräs Adiabaattinen prosessi Se on se, jossa järjestelmän ja sen ympäristön välillä ei ole lämmönvaihtoa joko siksi, että se tapahtuu eristävässä väliaineessa, tai koska se kulkee hyvin nopeasti. Tämä tarkoittaa, että järjestelmän ympäristössä tämä on tutkittavan maailmankaikkeuden osa, lämpötilan muutoksia ei pidä kokea, vaan vain työskennellä.
Tämä on yksi termodynamiikan alkuaineprosesseista. Toisin kuin muut prosessit (isocoric, isobarinen ja isoterminen), mikään sen fyysisistä muuttujista ei pysy vakiona; toisin sanoen paineen, tilavuuden, lämpötilan ja entropian muutoksen suuruudet adiabaattisen prosessin kehittyessä.
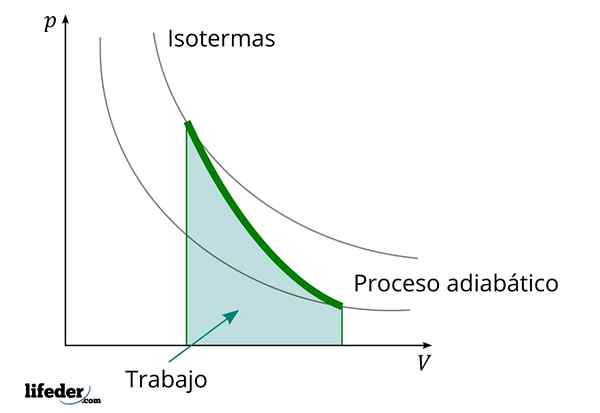
 Adiabaattisen prosessin aikana, jossa tilavuus kasvaa, työn sisäinen energia vähenee
Adiabaattisen prosessin aikana, jossa tilavuus kasvaa, työn sisäinen energia vähenee Toinen tärkeä ominaisuus adiabaattisille prosesseille on, että ne suorittavat tai kuluttavat työtä suhteessa järjestelmänsä sisäisen energian variaatioon; Tässä tapauksessa sen molekyyleistä kaasufaasissa. Tämä voidaan osoittaa ensimmäisen termodynamiikan lain ansiosta.
Tämän tyyppinen prosessi kattaa jokapäiväisessä elämässä ennen kaikkea geofysikaalisiin ilmiöihin ja jossain määrin mäntien toiminta dieselmoottoreissa. Lämmönsiirto estetään usein eristävää väliaineen avulla, mutta näiden prosessien nopeus sallii niiden todellisen kehityksen.
[TOC]
Palautuvat ja peruuttamattomat adiabaattiset prosessit
Palautuva
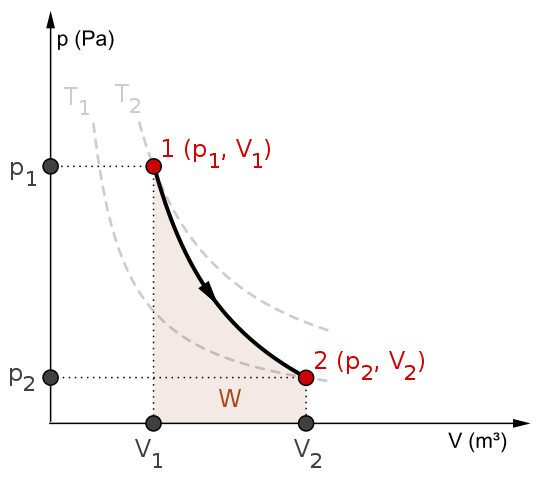 P-V-kaavio ja työ W adiabaattiseen prosessiin. Lähde: Mikerun/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0)
P-V-kaavio ja työ W adiabaattiseen prosessiin. Lähde: Mikerun/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0) Adiabaattiset prosessit voivat olla palautuvia tai peruuttamattomia. Ensimmäiset ovat kuitenkin vain teoreettisia välineinä jälkimmäisen tutkimiseksi. Siten palautuvat adiabaattiset prosessit sisältävät ihanteelliset kaasut, ja niistä puuttuu kitka ja muut mahdollisuudet, jotka aiheuttavat lämmönsiirtoa järjestelmän ja sen ympäristön välillä.
Harkitse esimerkiksi P-V-kaaviota palautuvaa adiabaattista prosessia ylhäältä. T1 ja T2 vastaa kahta isotermia, joihin paineet P ja volyymit V järjestelmä vaihtelee.
Valtioiden keskuudessa (P1, V1) Ja p2, V2) Suoritetaan palautuva adiabaattinen laajennus, koska siirrymme Volume V: stä1 yhdelle v2, isompi, nuolen suunnan jälkeen.
Näin toimiessa järjestelmä jäähtyy, mutta noudattamatta isotermien käyttäytymistä. Käyrän alla oleva alue vastaa työtä W, jonka arvo on positiivinen, koska se on laajennus.
Tässä prosessissa entropia pysyy vakiona, ja siksi sanotaan, että se on isontrooppinen. Tämän palautuvuuden matemaattinen käsittely tuottaa joukon yhtälöitä, joiden kanssa on mahdollista arvioida muita järjestelmiä.
Voi palvella sinua: elektrolyyttiset solutPeruuttamaton
Peruuttamattomat adiabaattiset prosessit, toisin kuin palautuvat, eivät ole graafisia P-V-kaavioissa, joilla. Nämä prosessit sisältävät todellisia kaasuja, joten ihanteellisten kaasujen yhtälö ja niiden johdannaiset eivät ole suoraan sovellettavissa niihin.
Ne kulkevat nopeasti, estäen lämmönsiirron järjestelmän ja sen ympäristön välillä. Lisäksi niissä entropia kasvaa, kuten termodynamiikan toisessa laissa todetaan.
Esimerkkejä adiabaattisista prosesseista
 Eristämiskyky, kuten termosten esittämät, on yksi keskeisistä tekijöistä prosessin kehittymiselle
Eristämiskyky, kuten termosten esittämät, on yksi keskeisistä tekijöistä prosessin kehittymiselle Joitakin esimerkkejä adiabaattisista prosesseista mainitaan alla.
Laajennus ja ymmärrys
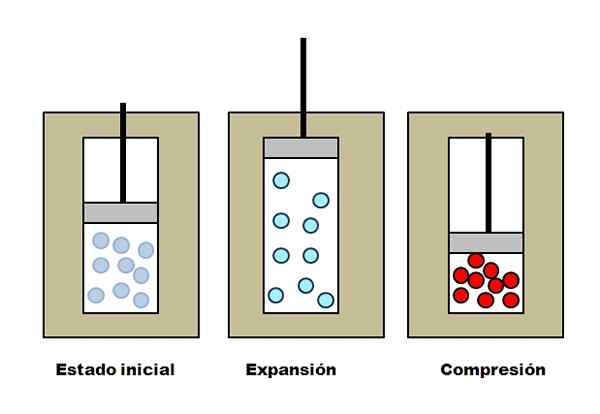 Adiabaattinen laajennus ja ymmärrys. Lähde: Gabriel Bolívar.
Adiabaattinen laajennus ja ymmärrys. Lähde: Gabriel Bolívar. Oletetaan, että kolme eristävää liiviä, jotka sisältävät osastoja täynnä kaasua. Alkuvaiheessa mäntä ei ole painetta kaasua. Sitten männän annetaan nousta, mikä lisää tilavuutta, jonka läpi kaasumolekyylit voivat liikkua, aiheuttaen sen sisäisen energian vähentymisen; Ja siksi lämpötilan lasku.
Päinvastoin tapahtuu adiabaattisen kompression kanssa: mäntä suorittaa kaasun työtä vähentäen sen tilavuutta, jonka sen molekyylit voivat käyttää. Sisäinen energia kasvaa tällä kertaa, mikä merkitsee myös lämpötilan nousua, jonka lämpö ei voi hajonnut ympäristöä kohti eristysliivin takia.
Magman nousu
Kanavat, joissa magma nousee tulivuoren sisällä.
Äänen leviäminen
Kaasut ovat häiriintyneet ja laajennetaan ääniaallon mukaan jäähdyttämättä tai kuumaa niitä ympäröivää ilmaa.
Foehn -vaikutus
Foehn -vaikutus on esimerkki adiabaattisista prosesseista geofysiikan alalla. Ilmamassat nousevat kohti vuoren yläosaa, jossa he kokevat vähemmän painetta, joten heidän molekyylinsä laajenevat ja viileät, mikä johtaa pilven muodostumiseen.
Ne kuitenkin tuskin laskeutuvat vuoren toiselle puolelle, paine kasvaa ja siksi molekyylit puristetaan ja nostavat niiden lämpötilaa aiheuttaen pilven katoamisen.
Voi palvella sinua: kloorobentseeni (C6H5CL)Seuraavassa videossa tätä ilmiötä voidaan arvostaa:
Ratkaisut
Lopuksi pari harjoitusta ratkaistaan. On tärkeää, että seuraavat yhtälöt ovat käsillä:
ΔU = Q - W (termodynamiikan ensimmäinen laki)
Mutta ilman lämmönsiirtoa, Q = 0 y:
ΔU = - W (1)
Tämä on: Jos työ W on positiivinen, ΔU on negatiivinen ja päinvastoin. Toisaalta meillä on myös:
W = -nCVΔt (2)
Se, kun olet soveltanut ihanteellista kaasun yhtälöä (pv = nRt), ja T: n korvaaminen ja ratkaiseminen2 ja T1 meillä tulee olemaan:
W = (cV/R) (P1V1 - P2V2) (3)
On R: n arvo yhtä suuri kuin 0.082 l · atm/mol · k tai 8.314 j/mol · k
Adiabaattisissa prosesseissa on tärkeää tietää C -suhdeP/CV tunnetaan nimellä γ:
γ = cP/CV (4)
Joka mahdollistaa T-V- ja P-V-suhteiden luomisen:
T1V1γ-1 = T2V2γ-1 (5)
P1V1γ = P2V2γ (6)
Ja myös C: n likimääräiset lämmitteetP ja cV Ne vaihtelevat riippuen siitä, ovatko kaasut monoatomia, diatomia jne.
Harjoitus 1
Kaasu suorittaa 600 J: n työtä eristetyn osaston kautta. Mikä on sen sisäisen energian muutos? Lämpötilojen väheneminen tai kasvaja? Ja ottaen huomioon, että se on monoatominen kaasu, laske myös y y.
Tiedot:
W = +600J
ΔU = ¿?
γ =?
W -työ on positiivista, koska kaasu toimii ympäristössä. Eristetyn osaston sisällä q = 0, ja siksi meillä on yhtälö (1):
ΔU = - W
Eli ΔU on yhtä suuri kuin:
ΔU = - (+600J)
= -600J
Mikä tarkoittaa, että kaasun sisäinen energia laski 600 J. Jos ΔU laskee, samoin lämpötila, niin kaasu jäähtyy työn tekemisen seurauksena.
Koska tämä kaasu on monoatominen,
CV = 3/2 r
CP = 5/2 r
Ja oleminen
γ = cP/CV
= (5/2 R)/(3/2 R)
= 5/3 tai 1.66
Harjoitus 2
Kontissa 7 moolia O2 Ne puristettiin 15 litran ja 9 litran tilavuudesta. Tietäen, että alkulämpötila oli 300 K, laske: Kaasulle tehty työ.
Tiedot:
n = 7 moolia tai2
T1 = 300 K
V1 = 15 l
V2 = 9 l
W = ¿?
Se on peruuttamaton adiabaattinen ymmärrys. Meillä on kaksi yhtälöä ratkaistaksesi W:
W = -nCVΔt (2)
W = (cV/R) (P1V1 - P2V2) (3)
Paineet voivat laskea ne, mutta aikaa säästääksesi on parempi jatkaa yhtälöiden kanssa:
Voi palvella sinua: tislattua vettäW = -nCVΔt
= -nCV (T2-T1-A
Tarvitsemme cV ja T2 W: n määrittämiseksi. Happea, joka on diatominen kaasu, on cV yhtä suuri kuin 5/2 r:
CV (JOMPIKUMPI2) = 5/2 r
= 5/2 (8.314 J/mol · K)
= 20.785 j/mol · k
Meidän on laskettava t2. Siirrymme yhtälöön (5):
T1V1γ-1 = T2V2γ-1
Mutta ennen sen käyttämistä sinun on määritettävä ensimmäinen cP ja γ:
CP (JOMPIKUMPI2) = 7/2 r
= 7/2 (8.314 J/mol · K)
= 29.099 J/mol · K
Γ yhtä suuri kuin:
γ = cP/CV
= (29.099 J / mol · K) / 20.785 j/mol · k
= 1.4
Joten voimme puhdistaa tämän2 Yhtälöstä (5):
T1V1γ-1 = T2V2γ-1
T2 = (T1V1γ-1) / (V2γ-1-A
= [(300k) (15L)1.4-1] / (9L)1.4-1
= 368.01 K
Ja lopuksi ratkaisemme W:
W = -nCVΔt
= -(7 mol O2) (kaksikymmentä.785 J/mol · K) (368.01 K - 300 K)
= -9895.11 J O -9.895 kJ
Harjoitus 3
Neonsäiliö laajenee adiabaattisesti ja aluksi huoneenlämpötilassa (t = 298k) 12 litrasta 14 litraan. Tietäen, että sen alkuperäinen paine oli 3 atm, mikä on kaasun tekemä työ?
Tiedot:
T1 = 298 K
V1 = 12 L
V2 = 14 L
P1 = 3 atm
W = ¿?
Yhtälö (3) antaa meille mahdollisuuden määrittää W paineiden arvoilla:
W = (cV/R) (P1V1 - P2V2-A
Mutta meiltä puuttuu cV Ja p2.
Lopullinen paine voidaan laskea yhtälöllä (6):
P1V1γ = P2V2γ
On γ yhtä suuri kuin CP/CV. Koska neon on monoatominen kaasu, meillä on sen C -arvotP ja cV Ne ovat vastaavasti 5/2R ja 3/2R. Laskemme sitten γ:
γ = cP/CV
= (5/2R)/(3/2R)
= 5/3 tai 1.66
Tyhjentämme p2 Yhtälöstä (6):
P2 = (P1V1γ) / V2γ
= [(3 atm) (12 l)5/3] / (14 l)5/3
= 1.40 atm
Ja työ on yhtä suuri kuin:
W = (cV/R) (P1V1 - P2V2-A
= (3/2) [(3 atm) (12 l) - (1.40 atm) (14 l)] (101300 PA/1 atm) (0.001 m3/L) (KJ/1000 J)
= 2.49 kJ
Muutostekijöitä käytetään L · ATM A PA · M: n muuntamiseen3, joka vastaa 1 J. Neonkaasu laajenee, joten sen paine laskee ja tehdessään ympäristössä tämä on positiivinen. Lisäksi sen sisäinen energia ΔU laskee, samoin kuin sen lämpötila, jäähdytys laajennusprosessissa.
Viitteet
- Walter J. Moore. (1963). Fysikaalinen kemia. Kemiallisessa kinetiikassa. Neljäs painos, Longmans.
- Iranin. Levine. (2009). Fysikaalis -periaatteet. Kuudes painos. MC Graw Hill.
- Wikipedia. (2020). Adiabaattinen prosessi. Haettu: vuonna.Wikipedia.org
- Jones, Andrew Zimmerman. (18. elokuuta 2020). Themodynamiikka: Adiabaattinen prosessi. Toipunut: Admingco.com
- Devoe Howard & Neils Tom. (9. elokuuta 2020). Adiabaattiset muutokset. Kemian librettexts. Palautettu: Chem.Librettexts.org

