Isobariset prosessin kaavat, yhtälöt, kokeet, harjoitukset

- 4470
- 946
- Kelly Kilback
Jonkin sisällä isobarinen prosessi, paine P Järjestelmä pysyy vakiona. Etuliite "ISO" on peräisin kreikasta ja sitä käytetään merkitsemään, että jokin pysyy vakiona, kun taas "Baros", myös kreikasta, tarkoittaa painoa.
Isobariset prosessit ovat hyvin omia sekä suljetuissa astioissa että avoimissa tiloissa, ne ovat helppo löytää ne luonnossa. Tällä tarkoitamme, että fysikaaliset ja kemialliset muutokset ovat mahdollisia ilmakehän avoimissa säiliöissä maallisella pinnalla tai kemiallisilla reaktioilla.
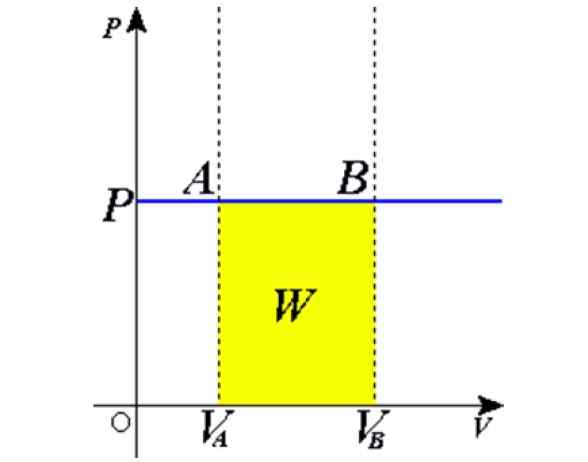 Kuvio 1. Isobarinen prosessi: sininen vaakasuora viiva on isobara, mikä tarkoittaa jatkuvaa painetta. Lähde: Wikimedia Commons.
Kuvio 1. Isobarinen prosessi: sininen vaakasuora viiva on isobara, mikä tarkoittaa jatkuvaa painetta. Lähde: Wikimedia Commons. Joitakin esimerkkejä saadaan lämmittämällä aurinkoon ilmapallo, joka on täynnä ilmaa, keittämistä, kiehua tai jäädyttävää vettä, kattiloissa syntyvää höyryä tai kuuman ilmapallojen nostamisprosessi. Myöhemmin annamme selityksen näistä tapauksista.
[TOC]
Kaava ja yhtälöt
Johdetaan yhtälö isobariselle prosessille olettaen, että tutkittava järjestelmä on ihanteellinen kaasu, melko sopiva malli melkein mille tahansa kaasulle alle 3 paine -ilmakehässä. Ihanteelliset kaasuhiukkaset liikkuvat satunnaisesti, miehittävät koko tilan tilavuuden, joka sisältää niitä vuorovaikutuksessa toistensa kanssa.
Jos siirrettävällä männällä varustettuun sylinteriin lukittujen ihanteellisten kaasujen annetaan laajentua hitaasti, voidaan olettaa, että sen hiukkaset ovat aina tasapainossa. Sitten kaasu kohdistuu männän alueelle -Lla voima F Suuruus:
F = p.-Lla
Missä p Se on kaasun paine. Tämä voima käyttää työtä, joka tuottaa äärettömän siirtymän Dx Männässä, jonka on antanut:
dw = fdx = pa.Dx
Tuote ADX Se on tilavuuserot DV, niin Dw = pdv. Se on edelleen integroida molemmat osapuolet alkuperäisestä tilavuudesta V-Lla Lopulliseen tilavuuteen asti VB - Kaasun tekemän kokonaistyön saaminen:


[TOC]
Kokeet
Kuvattu tilanne varmennetaan kokeellisesti kaasun konfigurointi sylinterissä, joka on varustettu siirrettävällä männällä, kuten kuvioissa 2 ja 3 esitetään. Mäntä asetetaan männään, jonka paino on suunnattu alas, kun taas kaasu kohdistaa voiman männän tuottavan P -paineen ansiosta.
Se voi palvella sinua: IMANTANTION: Mikä koostuu, menetelmä ja esimerkit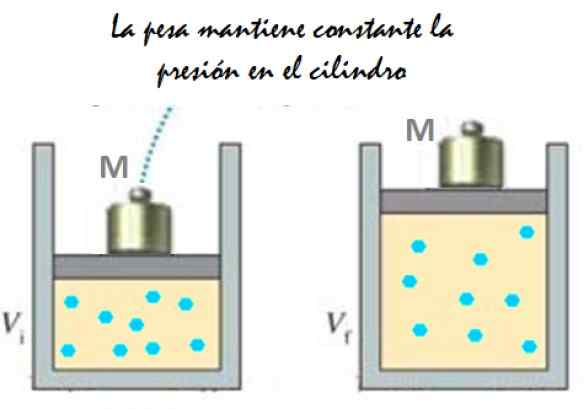 Kuva 2. Koe, joka koostuu jatkuvan painekasen laajentamisesta. Lähde: f. Zapata.
Kuva 2. Koe, joka koostuu jatkuvan painekasen laajentamisesta. Lähde: f. Zapata. Koska mäntä pystyy liikkumaan vapaasti, kaasun miehittämä tilavuus voi muuttua ilman ongelmia, mutta paine pysyy vakiona. Ilmakehän paineen P lisääminenPankkiautomaatti, Se myös saa voiman alas, sinulla on:
Mg - p.A + PPankkiautomaatti . A = vakio
Siksi: p = (mg/a) + pPankkiautomaatti Se ei vaihtele, ellei m ja sen kanssa painoa muokataan. Lämmön lisääminen sylinteriin, kaasu laajenee lisäämällä tilavuuttaan tai se supistuu lämmön uutettaessa.
Isobariset prosessit ihanteellisessa kaasussa
Ihanteellinen kaasun tilayhtälö liittyy tärkeysmuuttujiin: Paine P, tilavuus V ja lämpötila t:
P.V = n .R -.T
Tässä n edustaa moolien lukumäärää ja R on ihanteellisten kaasujen vakio (voimassa kaikille kaasuille), joka lasketaan kertomalla Boltzmann -vakio Avogadro -numerolla, mikä johtaa:
R = 8.31 j/mol k
Kun paine on vakio, tilayhtälö voidaan kirjoittaa seuraavasti:
V/t = nr/p
Mutta NR/P on vakio, koska N, R ja P ovat. Joten kun järjestelmä siirtyy tilasta 1 toiseen osavaltioon 2, syntyy seuraava osuus, joka tunnetaan myös nimellä Charlesin laki:
V1/T1 = V2/T2
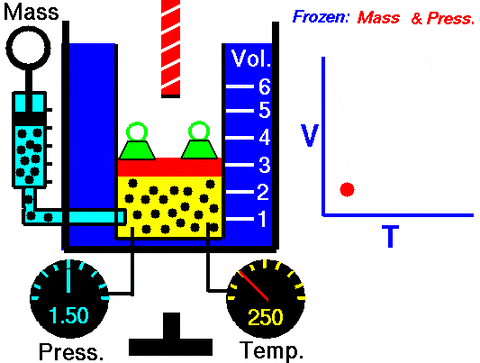 Kuva 3. Animaatio, joka osoittaa jatkuvan painekasen laajenemisen. Oikealla äänenvoimakkuuden kuvaaja lämpötilasta riippuen, mikä on viiva. Lähde: Wikimedia Commons. NASA: n Glenn Research Center [julkinen alue].
Kuva 3. Animaatio, joka osoittaa jatkuvan painekasen laajenemisen. Oikealla äänenvoimakkuuden kuvaaja lämpötilasta riippuen, mikä on viiva. Lähde: Wikimedia Commons. NASA: n Glenn Research Center [julkinen alue]. Korvaaminen W = pδv, Vakioiden ja lämpötilan vaihtelun suhteen tehdyt työt tehdään, jotta lämpömittarilla on helppo mitata vakioiden ja lämpötilan vaihtelun suhteen:
W -1 → 2 = nr (t2 - T1) = NR.Δt
Toisaalta termodynamiikan ensimmäinen laki osoittaa, että:
∆U = Q - W
Tämä tarkoittaa, että kaasun lisääminen tietyn määrän lämpöä Q, sisäinen energia ∆U kasvaa ja sen molekyylien värähtelyt kasvavat. Tällä tavoin kaasu laajenee ja suorittaa työtä syrjäyttämällä mäntä, kuten olemme aiemmin sanoneet.
Ihanteellisessa monoatomisessa kaasussa ja sisäisen energian variaatio ∆U, joka sisältää sekä kineettisen energian että sen molekyylien potentiaalienergian, on:
∆U = (3/2)Nr Δt
Viimeinkin yhdistämme yhdessä saamamme lausekkeet:
Q - = ∆U + W = (3/2)Nr Δt + NR∆t = (5/2) Nr Δt
Vaihtoehtoisesti se voidaan kirjoittaa uudelleen massan M, lämpötilaeron ja uuden vakion suhteen Erityinen lämpölämpö vakiopaineessa lyhennetty cp, Kenen yksiköt ovat J/mol K:
Voi palvella sinua: Venus (planeetta)Q = m cp ∆t
Esimerkit
Kaikkia isobarisia prosesseja ei suoriteta suljetuissa astioissa. Itse asiassa tapahtuu lukemattomia termodynaamisia prosesseja ilmakehän paineesta, joten isobariset prosessit ovat luonteeltaan hyvin yleisiä. Tämä sisältää fysikaaliset ja kemialliset muutokset maan pinnalla, kemialliset reaktiot avoimissa astioissa ja paljon muuta.
Jotta isobariset prosessit tapahtuvat suljetuissa järjestelmissä, on välttämätöntä, että niiden rajat ovat riittävän joustavia, jotta tilavuuden muutokset ilman painetta vaihtelee.
Näin tapahtui männän kokeessa, joka siirtyi helposti, kun kaasu laajeni. Sama tapahtuu sulkemalla kaasu juhliin juhliin tai kuuma ilmapallo.
Täällä meillä on useita esimerkkejä isobarisista prosesseista:
Keitä vettä ja keitä
Tee- tai keittämiskastikkeiden kiehuva vesi avoimissa astioissa ovat hyviä esimerkkejä isobarisista prosesseista, koska kaikki kehittyvät ilmakehän paineessa.
Kun lämpöä lämmitetään, lämpötila ja tilavuus nousee ja jos lämpöä jatketaan, kiehumispiste lopulta saavutetaan, jossa vesifaasin muutos tapahtuu. Vaikka tämä tapahtuu, lämpötila pysyy myös vakiona 100 º C.
Jäädyttää
Toisaalta jäädyttäminen on myös isobarinen prosessi, tapahtuuko se järvellä talvella vai kotimainen jääkaappi.
Kuumenna ilmapallo, joka on täynnä ilmaa aurinkoon
Toinen esimerkki isobarisesta prosessista on ilma -paistetun ilmapallon tilavuuden muutos, kun se jätetään alttiiksi auringolle. Ensimmäinen asia aamulla, kun se ei ole kovin kuuma, maapallolla on tietty tilavuus.
Ajan kuluessa ja lämpötila nousee, maapallo myös kuumenee lisäämällä sen tilavuutta ja kaikki tämä tapahtuu vakiopaineessa. Maapallomateriaali on hyvä esimerkki riittävän joustavasta rajasta, jotta ilmasta tulee, kun se on lämmitetty.
Kokemus voidaan suorittaa myös säätämällä maapallo ilman inflaria lasipullon huipulla täynnä kolmannesta vedestä, joka lämmitetään Maria Bio of Mary. Heti kun vettä on lämmitetty, ilmapallo paisutetaan heti, mutta ei pidä huolehtia siitä, ettei se räjähtää, jotta se ei räjähtää.
Aerostaattinen ilmapallo
Se on kelluva alus ilman työntövoimaa, joka käyttää ilmavirtoja ihmisten ja esineiden kuljettamiseen. Maapallo on yleensä täynnä kuumaa ilmaa, joka on kylmempi kuin ympäröivä ilma, nousee ja laajenee, mikä tekee maapallosta karkean.
Voi palvella sinua: Triple PointVaikka ilmavirrat suoraan maapallolle, siinä on polttimia, jotka aktivoidaan kaasun lämmittämiseksi, kun haluat nousta tai ylläpitää korkeutta, ja ne deaktivoidaan laskeutuessa tai laskeutuessa. Kaikki tämä tapahtuu ilmakehän paineessa, oletettu vakio tietyllä korkeudella lähellä pintaa.
 Kuva 4. Kuuma ilmapallo. Lähde: Pixabay.
Kuva 4. Kuuma ilmapallo. Lähde: Pixabay. Kattilat
Kattiloissa höyry syntyy lämmittämällä vettä ja ylläpitämällä vakiopainetta. Sitten tämä höyry tekee käyttökelpoista työtä, esimerkiksi tuottaen sähköä termoelektrisissä laitoksissa tai käyttämällä muita mekanismeja, kuten veturit ja vesipumput.
Ratkaisut
Harjoitus 1
Lämpötilassa on 40 litraa kaasua 27 ° C: ssa. Löydä tilavuuden lisääntyminen lisäämällä lämpöä isobárisesti, kunnes se saavuttaa 100 ºC.
Ratkaisu
Charlesin lakia käytetään lopullisen määrän määrittämiseen, mutta huomio: lämpötilat on ilmaistava Kelvinissä, lisää vain 273 K jokaiseen:
27 ºC = 27 + 273 K = 300 K
100 ºC = 100 + 273 K = 373 K
Lähettäjä:
V1/T1 = V2/T2 ⇒ V2 = T2(V1/T1) = 373 ºC (40 l/300 K) = 49.7 L
Lopuksi tilavuuden lisäys on v2 - V1 = 49.7 L - 40 L = 9.7 L.
Harjoitus 2
5 toimitetaan 5.00 x 103 J energiasta ihanteelliseen kaasuun 2.00 x 103 J Ympäristösi työ isobarisessa prosessissa. Sitä pyydetään löytämään:
a) kaasun sisäisen energian muutos.
b) tilavuuden muutos, jos nyt sisäinen energia vähenee 4: llä.50 x 103 J ja 7 karkotetaan.50 x 103 J järjestelmän, ottaen huomioon jatkuva paine 1.01 x 105 Paa.
Liittää jhk
Käytetty ∆U = Q - W ja lauseessa annetut arvot korvataan: Q = 5.00 x 103 J ja W = 2.00 x 103 J:
=5.00 x 103 J - 2.00 x 103 J = 3.00 x 103 J -
Siksi kaasun sisäinen energia kasvaa 3: lla.00 x 103 J -.
Ratkaisu b
Volume muutos löytyy tehdystä työstä: W = p∆v:
∆U = Q - W = Q - P∆v
Lausunto vahvistaa, että sisäinen energia vähenee, siksi: ∆U= -4.50 x 103 J -. Se kertoo myös, että tietty määrä lämpöä karkotetaan: q = -7.50 x 103 J -. Molemmissa tapauksissa negatiivinen merkki edustaa laskua ja menetystä, sitten:
-4.50 x 103 J = -7.50 x 103 J - p∆v
Missä P = 1.01 x 105 Paa. Koska kaikki yksiköt ovat kansainvälisessä järjestelmässä, tilavuuden muutos on selvä:
∆v = (-4.50 x 103 J +7.50 x 103 J)/ (- 1.01 x 105 Paa) = -2.97 x 10-2 m3
Koska äänenvoimakkuuden muutos on negatiivinen, se tarkoittaa, että tilavuus laski, ts. Järjestelmä supistui.
Viitteet
- Byjou. Isobarinen prosessi. Toipunut: byjus.com.
- Cengel, ja. 2012. Termodynamiikka. 7. painos. McGraw Hill.
- XYZ -prosessi. Lisätietoja isobarisesta prosessista. Toipunut: 10 prosessin.X ja z.
- Serway, R., ULOLE, c. 2011. Fysiikan perusteet. 9na ed. Cengage -oppiminen.
- Wikipedia. Kaasulaki. Palautettu: on.Wikipedia.org.
- « 14 psykologista kokeilua erittäin kiistanalaisten ihmisten kanssa
- Alustamiskonsepti, tyypit ja esimerkit »

