Luvattu (pm) rakenne, ominaisuudet, hankkiminen, käyttö

- 1461
- 415
- Eddie Hackett
Hän luvattu Se on kemiallinen elementti, joka kuuluu Lantanids -luokalle. Se tunnistetaan PM -symbolilla ja sen atomiluku on 61. Se on radioaktiivinen metallinen kiinteä aine ja on epävakain elementti jaksollisen taulukon ensimmäisten 84 elementin suhteen.
Tätä elementtiä esiintyy luonnollisesti erittäin alhaisina pitoisuuksina (noin 4 x 10-viisitoista grammat / kg) tyyppisellä uraanilla, joka on uraanin mineraali, jossa luvattu on läsnä uraanin spontaanin fission vuoksi.
 Symboli, atomisluku ja lupauksen atomimassa. Lähde: ME/CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/2.5). Lähde: Wikimedia Commons.
Symboli, atomisluku ja lupauksen atomimassa. Lähde: ME/CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/2.5). Lähde: Wikimedia Commons. Huolimatta pulastaan maapallon kuoressa, se on havaittu Andromeda -tähdistöjen HR465 -tähden spektrissä, jonka pinnalla sen arvioidaan, että se on äskettäin muodostettu, koska minkään PM -isotoopin ei ole pidempi puoli -elämä, 17,, se on 17,, se on 17, 17,, se on 17, 17. 7 vuotta.
Se oli hyödyllistä esineissä, jotka loistavat pimeässä, mutta niiden radioaktiivisuuden vuoksi se lopetti käyttämisen näissä. Sitä käytetään materiaalin paksuuden ja ydinenergian akkujen mittaamiseen.
[TOC]
Löytö
Kemisti Tšekin Bohuslav Brauner epäili prometion olemassaolon vuonna 1902. Myöhemmin, vuonna 1914, englantilainen fyysikko Henry Moseley löysi tutkimuksissaan, että neodymiumin ja samariumin välillä puuttui elementti.
Myöhemmin, vaikka useat tutkijaryhmät (italialaiset vuonna 1924, amerikkalaiset vuosina 1926 ja 1938) ilmoittivat löytöistään, vaikeudet erottaa se muista elementeistä ja kopioiden toistaminen ei pystynyt tekemään ansioita.
 Jaakob a. Marinsky. Ornl / pubi -verkkotunnus. Lähde: Wikimedia Commons.
Jaakob a. Marinsky. Ornl / pubi -verkkotunnus. Lähde: Wikimedia Commons. Lopuksi, vuonna 1944 tutkijat Marinsky J.-Lla., Glendenin l.JA. ja Coryell C.D -d. He testasivat läsnäolonsa ja eristivät sen uraanin fission by -tuotteista Clinton Laboratories -ydinreaktorissa Oak Ridgessä Tennesseessä, Yhdysvalloissa.
 Larry E. Glendenin. Ornl / pubi -verkkotunnus. Lähde: Wikimedia Commons.
Larry E. Glendenin. Ornl / pubi -verkkotunnus. Lähde: Wikimedia Commons. He eivät kuitenkaan vaatineet löytöjen prioriteettia vasta vuonna 1946, koska he olivat täysin omistettuja salaisiin tutkimuksiin, jotka liittyvät puolustustoimintaan toisen maailmansodan aikana.
Nimitys
Vaikka tutkijat olivat ehdottaneet kutsua häntä "Clintoniumiksi" laboratorioiden kunniaksi, jossa he työskentelivät, Coryellin vaimo vakuutti heidät kutsumaan häntä "lupiksi" muistoksi kreikkalaisesta Titan Prometheuksesta tai Prometheuksesta.
 Charles D. Coryell. Kuvan kirjoittaja: Christian A. Coryell/GFDL (http: // www.GNU.Org/copyleft/fdl.HTML). Lähde: Wikimedia Commons.
Charles D. Coryell. Kuvan kirjoittaja: Christian A. Coryell/GFDL (http: // www.GNU.Org/copyleft/fdl.HTML). Lähde: Wikimedia Commons. Joidenkin kreikkalaisen mytologian tulkintojen mukaan Prometheus varasti jumalat tulen antamaan sen ihmiskunnalle, joten hänet rangaistaan julmasti kaikesta ikuisuudesta. Muiden legendojen mukaan se tarjosi ihmisille matematiikkaa, tiedettä, maataloutta ja lääketiedettä, ja jopa loi ihmisen.
Se voi palvella sinua: Clausius-Clapeyron yhtälö: Mihin se on, esimerkkejä, harjoituksia Prometheus -esitys saksalaisella kuvanveistäjällä. © El Grafo / CC-by-Sa-4.0 / pubi -verkkotunnus. Lähde: Wikimedia Commons.
Prometheus -esitys saksalaisella kuvanveistäjällä. © El Grafo / CC-by-Sa-4.0 / pubi -verkkotunnus. Lähde: Wikimedia Commons. Nämä epäilykset siitä, mikä oli Prometheuksen panos ihmiskuntaan, muistuttaa epävarmuutta siitä, kuka löysi elementin. Toisaalta Coryellin vaimon mukaan nimi oli perusteltu, koska tutkijat olivat "varastaneet jumalien tulipalon" löydettäessä sitä atomipommin salaisen ohjelman aikana.
Elektroninen rakenne
Tämän elementin sähköinen kokoonpano on:
1s2; 2s2 2p6; 3s2 3p6 3d -d10; 4s2 4p6 4d -d10; 5s2 5p6; 4F5 6s2;
joka voidaan myös ilmaista seuraavasti:
[Xe] 4F5 6s2.
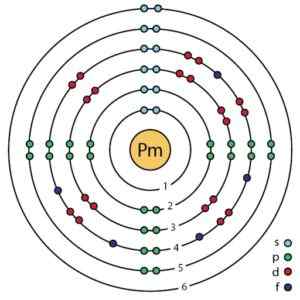 Prometio -elektroninen rakenne Bohrin parannettua atomimallia. Ahatsardi.ScienceWriter/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0). Lähde: Wikimedia Commons.
Prometio -elektroninen rakenne Bohrin parannettua atomimallia. Ahatsardi.ScienceWriter/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0). Lähde: Wikimedia Commons. Nimikkeistö
- Luvattu, PM -symboli.
- Prometio-147, PM-147 tai 147PM: Isotope del Prometio atomismassalla 147.
Prometion ominaisuudet
Fyysinen tila
Sileä metallinen kiinteä, kuusikulmakiteet.
Atomimassa
144,91
Sulamispiste
1042 ºC
Kiehumispiste
3000 ºC
Tiheys
7,26 g/cm3
Kemialliset ominaisuudet
Se kuuluu lantanidien, lantanoidien tai "harvinaisten maametallien" perheeseen, jota kutsutaan niin, koska maankuoressa he ovat aina oksidien muodossa. Ovat osa elementtien jaksollisen taulukon ajanjaksoa 6.
Kuultujen lähteiden mukaan pääministeri, kuten muutkin lantanidit, reagoi suoraan veden kanssa, hitaasti kylmä, nopeasti kuumennettaessa, vapauttaen vetyä (H2-A. Se tummenee nopeasti ilmassa ja palaa helposti tuottaen oksidiaan.
Yli 30 prometioyhdistettä on valmistettu ja useimmiten siinä on jonkin tyyppistä väriä. Sen hapettumistila näissä yhdisteissä on +3. Ei muodosta tetravalenttia kationeja.
Joidenkin yhdisteiden muodostuminen
Sen liuottaminen suolahapossa (HCL) luvattu muodostaa PMCL: n3 joka on keltainen ja vesiliukoinen. Typpihapossa (HNO3) PM syntyy (ei3-A3 se on vaaleanpunainen ja myös liukoinen veteen.
Jos liuos, joka sisältää PM -ionit3+ on alkaloitu NH: n kanssa3, Toisin sanoen pH nostetaan, hydroksidi saostuu (PM (OH)3) vaalean ruskea.
Voi palvella sinua: Ionilinkki: Ominaisuudet, miten se muodostuu ja esimerkkejäPm -sulfaatti2(SW4-A3 Se on hiukan liukeneva veteen. Jos prometion oksalaattia lämmitetään, siitä tulee PM -oksidi2JOMPIKUMPI3 valkoinen tai laventeli.
Radioaktiivinen päästö
Emittoi beetasäteilyä elektronien muodossa, jotka jättävät heidän atomiensa ytimen. Sen myöntäessä siitä tulee samarium -elementti (SM). Toisaalta siitä voi tulla neodyymi (ND) eliminoimalla ytimen positroni ja elektronin sieppaaminen samassa. Pm ei lähetä gammasäteitä.
Isotoopit
Toistaiseksi tunnetaan 14 prometion isotooppia, atomimassat, jotka vaihtelevat 134 - 155. Kaikki ovat epävakaita (radioaktiivisia), joka erottaa sen muista Lantanidesista.
Prometio-147 on suurin hyödyllisyys ja puoliintumisaika on 2,6 vuotta.
Isotooppi suuremmalla puolella
Pisin puoliintumisajan isotooppi on prometio-145, jonka 17,7 vuotta, joka hajoaa elektronisella sieppauksella, joka koostuu atomielektronista, yhdistetään protoniin ja muodostaa neutronin ja neutriino.
Se on kuitenkin PM: n ainoa isotooppi, joka voi myös kärsiä alfa -hajoamisesta (kahden neutronin päästö). Tämä johtuu siitä, että siinä on 84 neutronia ja kahden niistä liikkeeseenlasku tekee siitä prometio-141: n 82 neutronilla, mikä on ytimen vakaa kokoonpano. Mutta tämä on eräänlainen rappeutuminen, joka tapahtuu hyvin vähän.
Nykyinen hankkiminen
Vuonna 1963 valmistettiin noin 10 grammaa prometiaa käyttämällä ioninvaihtokromatografiamenetelmiä atomi -reaktorin polttoainejätteet. Nykyään se on edelleen toipumassa tällä tavalla suoloina 147P3+.
Tiettyjen lähteiden mukaan se valmistettiin myös noina vuosina fluoridin vähentämisen kautta (PMF3) Litiumhöyryllä (Li). Se valmistetaan myös kloridin vähentämisellä (PMCL3) Kalsiumin (CA) kanssa korkeissa lämpötiloissa.
Se voidaan saada myös neodyymi-146: lta. Tämä isotooppi altistetaan neutronien kanssa siten, että jokainen atomi vangitsee neutronin ja muuttuu neodyymi-147. Jälkimmäinen vie noin 11 päivää, joka kärsii beeta-hajoamisesta, joten se muuttuu prometio-147: ssä.
Sovellukset
Isotooppi 147 (147Pm) on se, jota on käytetty eniten, ja se on ainoa, joka löytyy kaupallisesti. Ei säteile gammasäteitä ja toimitetaan oksidin tai kloridin muodossa. Niiden kuljetus ja manipulointi vaativat kuitenkin suojaa säteilyä vastaan.
Se voi palvella sinua: hydrolyysi: mikä se on ja esimerkkejä reaktioistaSillä oli joitain käyttötarkoituksia, joita nykyään ei enää ole, koska sitä käytetään tällä hetkellä erityissovelluksissa.
Paristoissa
Prometio-147: tä käytetään pitkäaikaisissa atomiparistoissa. Tässä tapauksessa PM: n pienet palat asetetaan puolijohteen matriisiin beetapäästöjen muuttamiseksi sähköksi.
Tämäntyyppiset ydinenergia -akut voivat tarjota energiaa noin viideksi vuodeksi, ja niitä on käytetty kaikentyyppisissä laitteissa, ohjuksista tahdistimiin, jotka on asetettu potilaille, joilla on sydänongelmia.
 Sydämentahdistimilla voi olla pitkäaikaisia paristoja, jotka perustuvat prometioon. Kirjoittaja: 242799. Lähde: Pixabay.
Sydämentahdistimilla voi olla pitkäaikaisia paristoja, jotka perustuvat prometioon. Kirjoittaja: 242799. Lähde: Pixabay. Lääketieteellisissä sovelluksissa
Tiettyjen lähteiden mukaan prometion oksidia käytetään lääketieteessä säteilylähteenä.
Teollisuudessa
Sitä on käytetty joidenkin materiaalien paksuuden mittaamiseen, mikä tehdään mittaamalla näytteiden läpi kulkeva beetasäteily.
Mahdolliset sovellukset
Sitä voitaisiin käyttää kuljetettavana X -levyn lähteenä, mutta ilmeisesti tätä sovellusta ei ole vielä kehitetty kaupallisesti.
 Röntgenkuva, joka on saatu vuonna 1963 pienellä laitteella (noin 10 cm x 5 cm x 1 cm), joka sisältää prometio-147: n. Energia.Gov / Pub -verkkotunnus. Lähde: Wikimedia Commons.
Röntgenkuva, joka on saatu vuonna 1963 pienellä laitteella (noin 10 cm x 5 cm x 1 cm), joka sisältää prometio-147: n. Energia.Gov / Pub -verkkotunnus. Lähde: Wikimedia Commons. Sen tarkoituksena on myös tarjota energiaa avaruus- ja satelliittikoettimille tai tekemään laitteita, jotka sallivat viestintää sukellusveneiden kanssa.
Lopetettu käyttö kevyissä signaaleissa
Alun perin prometio-147: tä käytettiin radioelementin korvaamiseen valaisimissa, koska opittiin, että radio oli liian vaarallinen. Tätä varten PMCL sekoitettiin3 Luminoforeilla, jotka loistavat vihertävän keltaisesta siniseen, kun luvattujen (beetapartikkelien) säteily vaikuttaa niihin.
 Joitakin kymmeniä vuosia sitten rannekorujen neuloja voitiin nähdä pimeässä prometion radioaktiivisuuden aiheuttaman kirkkauden vuoksi. Kirjoittaja: Monacocannes. Lähde: Pixabay.
Joitakin kymmeniä vuosia sitten rannekorujen neuloja voitiin nähdä pimeässä prometion radioaktiivisuuden aiheuttaman kirkkauden vuoksi. Kirjoittaja: Monacocannes. Lähde: Pixabay. Tätä ominaisuutta käytettiin rannekorukelloissa tai valitsimissa loistaakseen pimeässä. Myös joidenkin loistelamppujen sytytyspainikkeessa. Lisäksi se ei vahingoittanut luminoforeja, kuten muiden beetasäteilylähteiden tapauksessa, pidentäen laitteiden käyttöikää.
Kuitenkin, kun havaittiin, että lupaaminen on myös vaarallista, sen käyttö pimeässä loistavien esineiden markkinoilla.
Riskejä
PM on radioaktiivinen elementti, joten sitä on manipuloitava erittäin varovaisesti ja asianmukaisella suojauksella. Sen lähettämien beeta -hiukkasten lisäksi nämä voivat vaikuttaa elementteihin, joilla on merkittäviä atomilukuja ja tuottaa x -säteitä.
 Prometionäytteet on kuljetettava paksun lyijykilven sisällä, jotta vältetään heidän lähettämänsä säteilyn haitalliset vaikutukset. Energia.Gov / Pub -verkkotunnus. Lähde: Wikimedia Commons.
Prometionäytteet on kuljetettava paksun lyijykilven sisällä, jotta vältetään heidän lähettämänsä säteilyn haitalliset vaikutukset. Energia.Gov / Pub -verkkotunnus. Lähde: Wikimedia Commons. Viitteet
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Prometium - PM (elementti). PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Ganjali, m.R -. et al. (2016). Johdanto Lanhanide -sarjaan (lanthanumista Lotteiumiin). Prometium. Lanthanides -sarjan määritys eri analyyttisillä menetelmillä. ScienEdirect.com.
- Choppin, G. et al. (2013). Maailmankaikkeuden ja nukleosynteesin alkuperä. Hidas neutronien sieppaus. Radiokemiassa ja ydinkemiassa (neljäs painos). ScienEdirect.com.
- Lyijy, d.R -. (Toimittaja) (2003). CRC: n kemian ja fysiikan käsikirja. 85th CRC -lehdistö.
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.
- Kuninkaallinen kemian yhdistys. (2020). Prometium. RSC toipunut.org.

