Veden fysikaaliset ja kemialliset ominaisuudet

- 2158
- 399
- Ronald Reilly
Se veden fysikaaliset ja kemialliset ominaisuudet Ne ovat kaikki ne veden ilmenemismuodot, joita voimme mitata molekyylien vuorovaikutuksen ansiosta itsestään tai ympäristöistään. Mutta mikä on vettä? Vesi on kemiallinen aine tai molekyyli, joka muodostuu happiatomin (O) yhdistämisellä kahdella vetyatomilla (H).
Nämä kolme atomia ovat edelleen yhdistyneet kovalenttisten sidosten muodostumisella, erittäin vahvat ja vakaat yhteydet. Vesimolekyyli on kaava H2Tai kyky kirjoittaa H-O-H: ksi. Juuri tämä molekyyli, sen linkit ja sen vuorovaikutukset ovat vastuussa värittömänä ja mauston nestemäinen aine.

Vesi on suuressa jakautuneessa osassa koko maata, tuoreen ja suolaisen veden välillä. Vesi on välttämätöntä, jotta elämä on olemassa planeetallamme, koska se on erittäin arvokas luonnonvara. Elävien organismien välillä on 60–70%, mikä on suuri osuus, joka antaa heille mahdollisuuden suorittaa lukemattomia toimintoja.
Joidenkin näiden elintärkeiden toimintojen joukossa ovat rakenteellisia, säätelijät, kuten kehon lämpötilan ylläpito ja pH -säätely (happamuus tai alkalisuus) normaalissa rajoissa. Samoin vesi suorittaa ravintoaineiden ja jätteiden kuljetuksen elävissä olennoissa.
Sitä käytetään myös monilla ihmisen tuottavan, teknologisen, tieteellisen ja päivittäisen rutiinin alueella; Wc: stä, ruoanlaitto, muun muassa.
[TOC]
Fysikaaliset veden ominaisuudet
Veden fysikaaliset ominaisuudet liittyvät ominaisuuksiin tai suuruuksiin, jotka voidaan mitata tai määrittää, kun tarkastellaan muun muassa ainetta, kuten sen massaa, energiaa.
Veden fysikaalisten suuruuksien joukossa ovat sen väri, haju, tapoja, joilla se löytyy, ja kaikki ne, jotka voimme määrittää ilman reaktioita tai muuttaa sen kemiallista koostumusta.
Maku
Maistamalla puhdasta vettä kitalaen mukaan osoittautuu, että se on turmeltunut tai mauston. Se on yhtä hajuton tai haju. Puhdistusprosessia varten voidaan havaita pieni haju, joka johtuu klooritähteistä. Mineraalit myöntävät vedelle erilaisia makukirjeitä.
Näkökohta

Vesi on yleensä väritön ja läpinäkyvä, kun sitä havaitaan lasilasissa. Vaikuttaa kuitenkin siltä, että sillä oli vaaleansininen väri, kun se kertyi suurina määrinä suuriin astioihin tai kun sitä havaitaan jäätiköissä, jokissa tai merissä.
Voi palvella sinua: Mitkä ovat tutkimuslähteet?Ja itse asiassa vedellä on tietty vaalea sinertävä väri, jonka havainto on keskittynyt, mitä suurempi veden määrä on.
Vesivaltiot
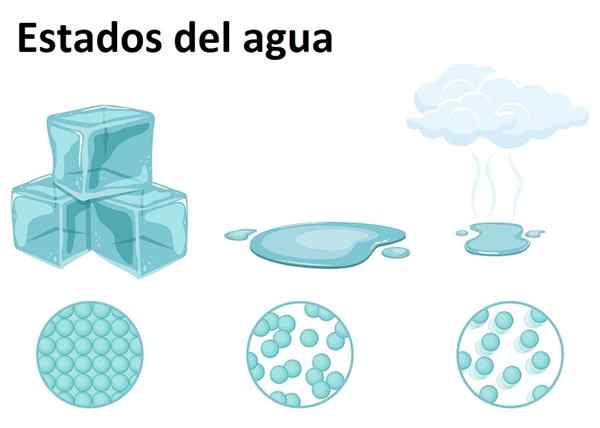 Kiinteä, nestemäinen ja kaasumainen tila
Kiinteä, nestemäinen ja kaasumainen tila Vettä on erittäin runsaasti maapallolla ja sitä löytyy mistä tahansa kolmesta ainetilasta: kiinteä, nestemäinen tai kaasumainen. Vesi huoneenlämpötilassa on nestemäinen aine, joka vastaa sen yleisintä muotoa.
Kiinteänä vettä kutsutaan jään tai lumiksi sen kiteiden koosta riippuen ja sen muodostumisprosessista. Samaan aikaan kaasumainen tila muodostuu, kun vesi kulkee nestemäisestä tilasta kaasumaiseen, muodostaen kuuluisan vesihöyryn, helposti tunnistettavissa keittiössä ja ruoan yläpuolella.
Tiheys
Puhdas vesitiheys vaihtelee noin 1 g/cm3. Samaan aikaan meriveden tiheys on hiukan korkeampi sen sisältämän suolan takia.
Jäätymispiste
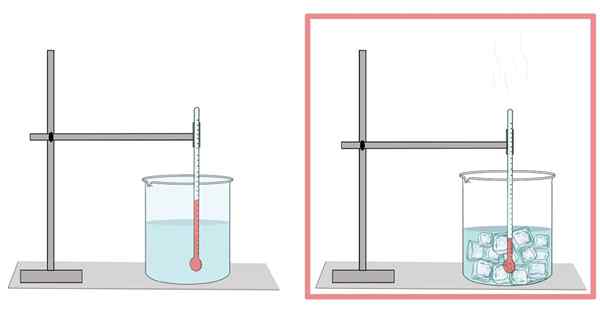
Vesi jäätyy 0 ° C: ssa. Tässä lämpötilassa siirtyy nestemäisestä faasista kiinteään. Kun vesi on jäädytetty, se laajenee. Siksi kiinteässä muodossaan sillä on vähemmän tiheyttä kuin nestemäisessä tilassaan, mikä helpottaa jään kelluvuutta nestemäisessä vedessä.
Samoin tämä on syy siihen, miksi pullon vesijäähdytystä ei pidä täyttää paljon, koska jää laajenee ja loppuu pullon murtamiseen.
Kiehumispiste
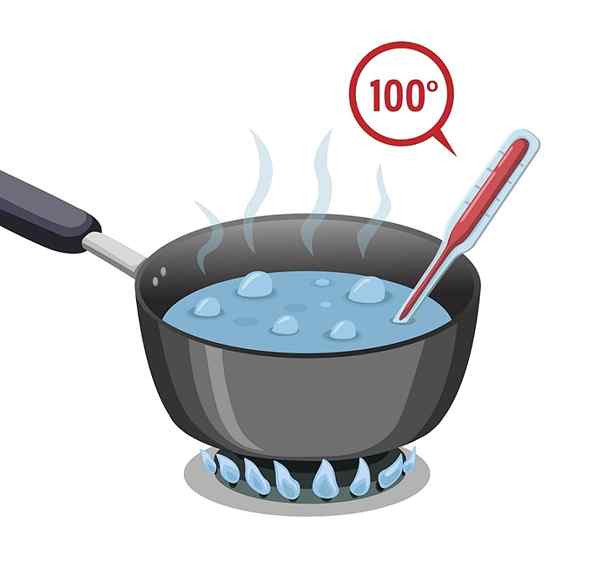
Vesillä on korkea kiehumispiste, joka on 100 ° C. Se on altistettava kuumana, jotta se voi lämmittää ja kiehua tai saavuttaa kiehumispisteen.
Vesillä on sitten korkea ominaislämpö tai sitä kutsutaan myös lämpökapasiteetiksi, mikä viivästyy lämmitykseen; Mutta myös jäähtyä, toisin sanoen hankitun lämmön menettämiseen tarvittava prosessi on hidasta.
Tämä ominaisuus tekee siitä erittäin hyödyllisen jäähdytysjärjestelmissä, muun muassa kehon lämpötilan säätelyjärjestelmissä.
Sähkönjohtavuus
Vesi on hyvä sähköjohdin. Puhtaalla vedellä on kuitenkin aina jonkin verran ioneja, mikä antaa sille ominaisuuden, jolla on yksi korkeimmista dielektrisistä vakioista ei -metallisissa nesteissä.
Yhteenkuuluvuus
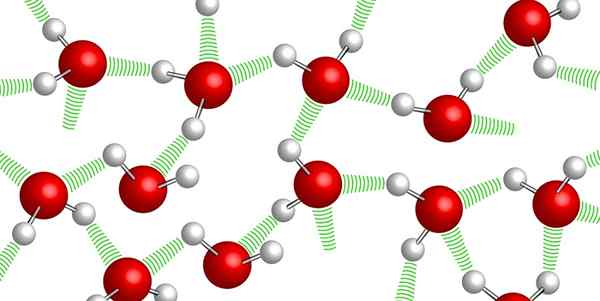 Vety sillat vesimolekyylien välillä
Vety sillat vesimolekyylien välillä Vesimolekyylit pysyvät yhdessä keskenään So -nimellä olevien vety sitojen ansiosta: heikot sidokset, jotka on muodostettu yhden ja toisen vesimolekyylin väliin. Tästä korkeasta koheesiotasosta johtuen on erittäin vaikea puristaa vettä.
Voi palvella sinua: 7 dokumenttitutkimusvälinettäLiittyminen

Veden on helppo tarttua esimerkiksi lasin hyvin puhtaaseen pintaan, muodostaen kalvon, jota kutsumme kosteukseksi tai "märkäksi". Myös vesi tarttuu nopeasti ihoomme, joten kastelemme heti, kun pääsemme uima -altaaseen. Muuten kuivumme sekunneissa.
Pintajännitys
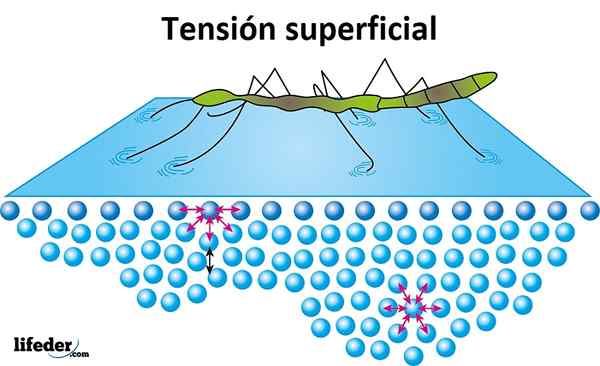
Pintajännitys on nesteen tarjoama vastus sen pinnalla tunkeutuvaksi. Vesillä on korkea pintajännitys, molekyylien välillä esiintyvän koheesion tuote, mikä tekee siitä helposti muodostuvan, sen sijaan, että leviäisi vapaasti sileän pinnan.
Pintajännitys näkyy, kun hyönteiset näyttävät liikkuvan tai kävelevän vedellä uppoutumatta, ja se on syy siihen, miksi jotkut lehdet tai muut kevyet esineet voivat kellua veden yli.
Kapillaarisuus

Helppo, jolla vesi nousee tai matala kapillaariputken läpi, kuvaa veden kapillaarisuusominaisuutta. Tämä ominaisuus johtuu myös veden korkeista ominaisuuksista ja tarttuvuudesta.
Kasvien luonto hyödyntää kapillaarisuutta toimittaakseen vettä puun korkeimpien oksien lehtiä ja helpottaa sen imeytymistä kasvien juurten kautta.
Samoin pintajännityksen ja kapillaarisuuden ominaisuudet tekevät vedestä solujen rakenteellisen osan, joka on osa verta ja joka kulkee tai virtaa helposti eri verisuonten läpi.
Liuotintoiminta

Vesi voi liuottaa monia aineita, mikä on elintärkeää eläville organismeille, koska kaikki elävien olentojen kemialliset reaktiot tapahtuvat vesipitoisessa ympäristössä. Elävissä organismeissa se toimii ravinteiden, ionien ja monien muiden aineiden kuljetuksena.
Se palvelee myös jätteiden, kuten urean, kuljettamista, joka eliminoituu virtsaan. Kun aine liukenee ja sekoittuu hyvin veden kanssa, sanotaan, että se on hydrofiilinen tai hydrosolo. Jos et sekoita tai liukene hyvin, sanotaan, että aine on hydrofobinen tai liukenematon veteen.
Kemialliset veden ominaisuudet
Kemialliset ominaisuudet tai ominaisuudet ovat sellaisia, jotka tapahtuvat, kun veden kemiallisen rakenteen muutoksia tuotetaan. Sitten on tärkeää tarkastella lyhyesti sen molekyylirakennetta.
Kemiallinen luonne
Vesi on epäorgaaninen molekyyli, koska se ei sisällä C (hiili) ja sen kemiallinen kaava on H2JOMPIKUMPI. Niiden atomeihin liittyy jakamalla elektroneja, jotka muodostavat kovalenttisia sidoksia, vahvoja ja erittäin vakaita linkkejä. Sen molaarimassa on 18 g/mol, ts. Yhden moolin veden massa on 18 grammaa.
Voi palvella sinua: Tieteellinen tutkimusVastakkaisuus
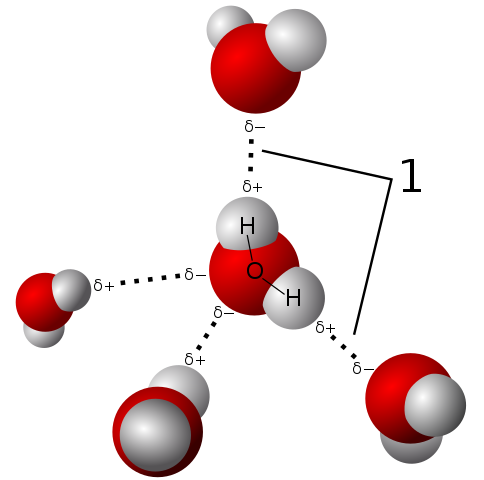 Veden napaisuus antaa sen molekyylin luoda erittäin vahvat vety sillat
Veden napaisuus antaa sen molekyylin luoda erittäin vahvat vety sillat Vesimolekyyli on neutraali, mutta sillä on tietty napaisuus, koska sen elektronien jakaminen ei ole niin oikeudenmukaista.
Kun happi houkuttelee voimakkaammin jaetut elektronit itselleen, vesimolekyyli on tällä puolella, jossa happi on taipumus olla jonkin verran negatiivista kuormitusta; Ja siksi se pysyy positiivisella osittaisella kuormalla, jossa hydrogenssit ovat (tarkkaile ylempää kuvaa).
Tämä napaisuus helpottaa liitosta vesimolekyylien kanssa ja vesiliitto muiden molekyylien kanssa, joilla on myös kuormituseroja niiden rakenteessa, mikä edistää edellisissä osioissa kuvattuja fysikaalisia ominaisuuksia.
Ionisaatio
Spontaanisti nestemäisessä vedessä on pieni ionisaatio tai itsesäätö. Se tarkoittaa, että jotkut sen molekyyleistä järjestetään uudelleen muuttamalla sen normaalia molekyylirakennetta tuottaen uusia sähköisesti ladattuja molekyylejä, kuten hydroniumioneja (H3JOMPIKUMPI+) ja hydroksyyli (OH--A.
Reaktiivinen kapasiteetti
Vesi reagoi monien aineiden kanssa muodostaen suuren monimuotoisuuden kemiallisista yhdisteistä. Elektrolyysillä vesi voidaan rikkoa erottamalla happi sen kahdesta vedosta. Tämä prosessi tapahtuu, kun sähkövirta kulkee veden läpi. Jopa vesi kiinteässä muodossaan voi olla myös osa joitain kemiallisia reaktioita.
PHE
 pH lähellä 7
pH lähellä 7 Puhtaalla vedellä on neutraali pH (yhtä suuri kuin 7), kun taas merivedet ovat hiukan emäksisiä (yli 7). Sadevesi on happamassa (pH alle 7) hiukan sekoitettuna ilmakehässä havaittujen komponenttien kanssa, kuten hiilidioksidi tai CO2, Esimerkiksi.
Antfoteerismi
Vesi on amfotaattia, toisin sanoen se voi käyttäytyä kuin happo tai emäksenä liuoksen pH: n mukaan. Tämä kemiallinen ominaisuus tukee sen roolia pH -säätelijänä.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Castillero m. JOMPIKUMPI. (2020). Psykologia ja mieli. Veden 15 fysikaalista ja kemiallista ominaisuutta. Toipunut: psykologia ja.com
- Wikipedia (2020). Veden ominaisuudet. Haettu: vuonna.Wikipedia.org
- Terävä k. -Lla. (S.F.-A. Vesi: rakenne ja ominaisuudet. Talteenotettu: Crystal.Lääketieteellinen.Umpin.Edu
- Byju. (S.F.-A. Veden fysikaaliset ja kemialliset ominaisuudet. Toipunut: byjus.com
- Koulun energia ja ympäristö. (S.F.-A. Vesi oli resurssi. Toipunut: Eariscuola.netto
- « Glycocálix -toiminnot, jotka se kohtaavat ja komponentit
- Contabalgation -käsite, tyypit, ominaisuudet »

