Mikä on kemiallinen kinetiikka?

- 1854
- 311
- Shawn Stanton II
Selitämme, mikä on kemiallista kinetiikkaa, järjestystä ja reaktion nopeutta, sekä nopeuteen vaikuttavat tekijät
Mikä on kemiallinen kinetiikka?
Se kemiallinen kinetiikka Kemiallisten reaktioiden nopeuden tutkimisesta vastaavat kemian haara, mitkä tekijät vaikuttavat tähän nopeuteen ja mitkä ovat yksittäiset mekanismit tai vaiheet, joiden läpi kemialliset reaktiot tapahtuvat.
Lisäksi se antaa meille mahdollisuuden ymmärtää monia kemiallisten reaktioiden näkökohtia, kuten kemiallista tasapainoa ja aktivointienergiaa, ja tutkimuksia katalyysiprosesseja. Jälkimmäinen tekee siitä erityisen tärkeän useissa sovelluksissa, biokemiasta teollisuustekniikkaan.
Kinetiikan keskellä on reaktionopeus, joka voidaan ymmärtää nopeudella, jolla reagenssit muuttuvat tuotteiksi. Kemiallisessa kinetiikassa on kuitenkin paljon tarkempi määritelmä.
Reaktionopeuden määritelmä
Aloitetaan seuraavan yleisen kemiallisen reaktion avulla, jotta voidaan antaa reaktionopeuden täydellinen määritelmä, sellaisena kuin se on käytetty kemiallisessa kinetiikassa:
Tässä reaktiossa A ja B edustavat reagensseja, C ja D edustavat tuotteita, kun taas A, B, C ja d -d Ne edustavat vastaavia stoikiometrisiä kertoimia.
Reaktionopeus (esitetty symbolilla v) Osoittaa kuinka nopea. Matemaattisesti tämä ilmaistaan seuraavasti:
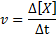
Missä Δ [x] edustaa lajien X (a, b, c tai d) molaarisen pitoisuuden muutosta aikavälillä Δt.
On selvää, että mitä nopeammin mitä tahansa reagensseja kulutetaan, sitä nopeammin muut reagenssit kulutetaan ja sitä nopeammin tuotteet tapahtuvat. Tästä syystä on tarpeen vain määritellä nopeus yhden niistä.
Se voi palvella sinua: menetelmät homogeenisten seosten erottamiseksiSen varmistamiseksi, että nopeuden laskennan tulos on aina sama, riippumatta siitä, mitkä lajit nopeus määritetään, se on aina jaettava stökiometrisen kertoimen välillä ja asetettava merkki vähemmän ennen yhtälöä, jos se on reagenssi. Tarkoittaen:
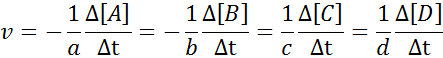
Esimerkki reaktionopeuden määritelmästä
Seuraava kemiallinen reaktio:
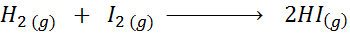
Kirjoita reaktionopeuden määritelmä jokaisesta kyseisestä lajista riippuen.
Ratkaisu:
H: n suhteen2-
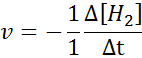
I: n suhteen2-
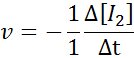
HI:
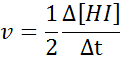
Nopeuslaki ja reaktion järjestys
Reaktiot tapahtuvat, kun atomit ja molekyylit törmäävät keskenään riittävällä energialla ja oikealla suuntauksella. Todennäköisyys, että tämä tapahtuu.
Tästä syystä nopeus riippuu melkein aina reagenssien pitoisuudesta. Joissakin tapauksissa nopeus riippuu myös minkä tahansa tuotteen pitoisuudesta, samoin kuin minkä tahansa ympäristössä läsnä olevan katalyytin tai estäjän pitoisuudesta.
Matemaattista yhtälöä, joka liittyy reaktion nopeuteen mukana olevien lajien pitoisuuteen, kutsutaan "NopeuslakiJa yksinkertaisemmissa tapauksissa sillä on seuraava muoto:
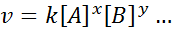
Missä k -k - Se on suhteellisuusvakio, jota kutsutaan nopeusvakio, ja A-, B: n ja muiden yhtälön esiintyvien lajien eksponentteja kutsutaan reaktiomääräykset.
Kaikkien reaktiojärjestysten summan (jota kutsutaan globaaliksi järjestykseksi) mukaan erityyppiset reaktiot voidaan erottaa. Nämä eroavat siitä, kuinka paljon pitoisuus vaikuttaa nopeuteen, sen ajan, joka kuluu puolet reagensseista (puoli -elämä) ja reagenssien pitoisuus muuttuu ajan myötä (kuvaajat [a] vs t t t -A.
-
Tilausreaktiot 0
Kun kaikki nopeuslain eksponentit ovat 0, nopeuslain yhtälö pienennetään:
Voi palvella sinua: koordinoitu kovalentt linkki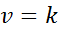
Toisin sanoen ne ovat reaktioita, jotka tapahtuvat vakiona nopeudella ja jossa nopeus ei riipu minkään reagenssin tai tuotteen pitoisuudesta.
Tilaa kaaviot 0
Ryhmäreaktioiden 0 kaavio [a] vs t t ovat laskevia suoria viivoja.
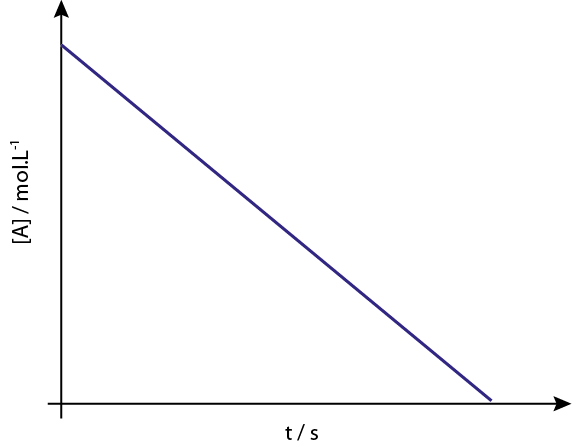
Legenda: Konsentraatiokaavio vs. Reaktion 0 aika antaa suoran linjan.
Keskimmäinen elämä tilaukselle 0
Tilauksen 0 reaktiolle, puoli -elämän aika (t1/2) Annetaan:
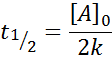
-
1. asteen reaktiot
Näissä reaktioissa nopeus vaihtelee lineaarisesti pitoisuuden mukaan. Ensimmäisen asteen nopeuslaki on:
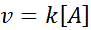
Ensimmäisen kertaluvun grafiikka
Ensimmäisen järjestyksen reaktioiden [a] vs. t t t -kuvaaja on laskevia hyperboloja. Kuitenkin, jos Neperian pitoisuuden logaritmi (ln [a]) vs. aika on kuvaaja, saadaan suora viiva.
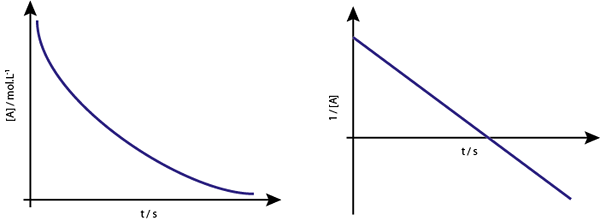 Konsentraatiokaavio vs. luokan 1 reaktion aika antaa hyperbolan, mutta pitoisuuden Neperian logaritmin kaavio antaa viivan
Konsentraatiokaavio vs. luokan 1 reaktion aika antaa hyperbolan, mutta pitoisuuden Neperian logaritmin kaavio antaa viivan Keskimmäinen elämä ensimmäisen järjestyksen reaktioille
Luokan 1 reaktiolle, t1/2 Se ei riipu alkuperäisestä pitoisuudesta ja sen annetaan:
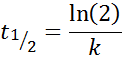
-
Toisen asteen reaktiot
Reaktio voi olla toisen asteen yhdestä reagenssista tai ensimmäisen asteen suhteen kahteen reagenssiin nähden. Ensimmäisessä tapauksessa nopeuslaki annetaan:
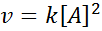
Toisen asteen grafiikka
Toisen järjestyksen reaktioiden [A] vs. T -kuvaaja on laskevia hyperboloja. Kuitenkin, jos pitoisuuden käänteinen (1/[a]) vs. aika on piirretty, saadaan suora viiva.
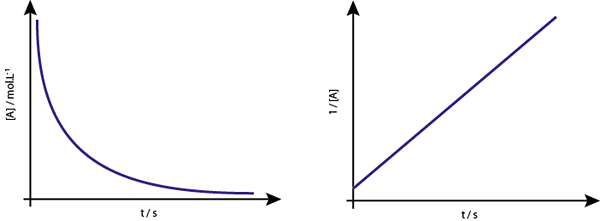 Konsentraatiokaavio vs. luokan 2 reaktion aika antaa käyrän, joka on samanlainen kuin laskeva hyperbola, mutta pitoisuuden kuvaaja verrattuna aika antaa viivan
Konsentraatiokaavio vs. luokan 2 reaktion aika antaa käyrän, joka on samanlainen kuin laskeva hyperbola, mutta pitoisuuden kuvaaja verrattuna aika antaa viivan Keskimmäinen elämä toisen asteen reaktioihin
Luokan 2 reaktiolle, t1/2 On annettu:
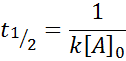
Tekijät, jotka vaikuttavat reaktionopeuteen
Lämpötila
Lämpötila lisää aina reaktioiden nopeutta, koska taajuus ja energia, jolla molekyylit törmäävät toisiinsa. Arrhenius -yhtälö antaa riippuvuuden reaktion nopeudesta lämpötilan kanssa.
Se voi palvella sinua: Magnesium hydridi: rakenne, ominaisuudet ja käytötPaine
Kasvava paine vastaa kaikkien lajien pitoisuuden lisäämistä reaktioväliaineessa (kaasufaasireaktioissa), joten paine nousee yleensä lisäämään reaktioiden nopeutta.
Katalyytit
Katalyyttit ovat kemiallisia aineita, jotka lisätään väliaineeseen vain reaktionopeuden lisäämiseksi. Useimmat katalyytit toimivat muuttamalla reaktiomekanismia yhdellä, joka vaatii pienempää aktivointienergiaa.
Yleiset katalyyttiesimerkit ovat entsyymit elävissä järjestelmissä ja jotkut metallit, kuten platina ja paladium.
Estäjät
Estäjät ovat katalyyttien vastakohta. Ne ovat aineita, jotka tekevät reaktioita hitaammin. Antikroosivia ovat esimerkkejä estäjistä, jotka pyrkivät vähentämään korroosioreaktioiden nopeutta, jotta metallipinnot tekevät enemmän.


