Mikä on isoterminen prosessi? (Esimerkkejä, harjoituksia)

- 1305
- 112
- Arthur Terry II
Hän isoterminen prosessi tai isotermi on palautuva termodynaaminen prosessi, jossa lämpötila pysyy vakiona. Kaasussa on tilanteita, joissa järjestelmän muutos ei tuota lämpötilan vaihteluita, vaan fyysisissä ominaisuuksissa.
Nämä muutokset ovat faasimuutoksia, kun aine muuttuu kiinteästä nesteeksi, kaasunestettä tai päinvastoin. Tällaisissa tapauksissa ainemolekyylit säätävät sijaintiaan, lisäämällä tai lisäämällä lämpöenergiaa.
 Kuvio 1. Sulavat karambanit ovat esimerkki isotermisestä prosessista. Lähde: Pixabay.
Kuvio 1. Sulavat karambanit ovat esimerkki isotermisestä prosessista. Lähde: Pixabay. Vaihemuutoksen välttämätön lämpöenergiaa aineessa kutsutaan piileväksi lämmöksi tai transformaatiolämpöksi.
Yksi tapa saada isoterminen prosessi on ottaa yhteyttä aineeseen, joka on tutkittava järjestelmä ulkoisella lämpövarastolla, joka on toinen suuri kalorikapasiteettijärjestelmä. Tällä tavoin tapahtuu tällainen hidas lämmönvaihto, että lämpötila pysyy vakiona.
Tämäntyyppiset prosessit annetaan usein luonteeltaan. Esimerkiksi ihmisillä, kun kehon lämpötila nousee tai laskeutuu, olemme sairaita, koska kehomme lukuisia kemiallisia reaktioita, jotka ylläpitävät elämää, annetaan vakiossa lämpötilassa. Tämä pätee kuumaveriin yleensä.
Muita esimerkkejä on jää, joka sulaa lämmöllä, kun kevät- ja jääkuutiot saapuvat.
[TOC]
Esimerkkejä isotermisistä prosesseista
-Kuumaveren eläinten aineenvaihdunta suoritetaan vakiossa lämpötilassa.
 Kuva 2. Kuumaverhoilla eläimillä on mekanismeja lämpötilan pitämiseksi. Lähde: Wikimedia Commons.
Kuva 2. Kuumaverhoilla eläimillä on mekanismeja lämpötilan pitämiseksi. Lähde: Wikimedia Commons. -Kun vesi kiehuu, kaasunestettä tapahtuu vaihemuutos, ja lämpötila pysyy vakiona noin 100 º C: ssa, koska muut tekijät voivat vaikuttaa arvoon.
-Sekava jää on toinen usein toistuva isoterminen prosessi, samoin kuin veden asettaminen pakastimeen jääkuutioiden valmistamiseksi.
Voi palvella sinua: Geometrinen optiikka: Mitä tutkimuksia, lakeja, sovelluksia, harjoituksia-Automoottorit, jääkaapit, samoin kuin monet muut koneet, toimivat oikein tietyssä lämpötila -alueella. Asianmukaisen lämpötilan ylläpitämiseksi laitteet kutsutaan Termostaatit. Suunnittelussaan käytetään erilaisia toimintaperiaatteita.
Carnotin sykli
Carnot -moottori on ihanteellinen kone, josta työ saadaan täysin palautuvien prosessien ansiosta. Se on ihanteellinen kone, koska se ei pidä prosesseja, jotka hajottavat energiaa, työn viskositeettina, joka tekee työn, eikä kitkaa.
Carnot -sykli koostuu neljästä vaiheesta, joista kaksi on tarkalleen isoterminen ja kaksi muuta adiabaattista. Isotermiset vaiheet ovat puristus ja kaasun laajentuminen, joka vastaa hyödyllisen työn tuottamisesta.
Automoottori toimii samanlaisia periaatteita. Männän liikkuminen sylinterin sisällä siirretään auton muihin osiin ja tuottaa liikettä. Sillä ei ole ihanteellisen järjestelmän käyttäytymistä, kuten Carnot -moottori, mutta termodynaamiset periaatteet ovat yleisiä.
Isotermisessä prosessissa tehdyn työn laskeminen
Järjestelmän tekemän työn laskemiseksi, kun lämpötila on vakio, on käytettävä ensimmäisen termodynamiikan laki, jossa todetaan:
Δu = q - w
Tämä on toinen tapa ilmaista energian säilyttäminen järjestelmässä, esitetty läpi ΔU tai energian muutos, Q - kuten lämpö on toimitettu ja lopulta W -, Mikä on mainitun järjestelmän tekemä työ.
Oletetaan, että kyseinen järjestelmä on ihanteellinen kaasu, joka sisältyy liikkuvan alueen männän sylinteriin -Lla, Mikä toimii, kun sen tilavuus V muutos V1 -lla V2.
 Kuva 3. Isotermisessä prosessissa kaasu laajenee männässä muuttamatta lämpötilaa. Lähde: YouTube.
Kuva 3. Isotermisessä prosessissa kaasu laajenee männässä muuttamatta lämpötilaa. Lähde: YouTube. Ihanteellinen kaasun tilayhtälö on Pv = nrt, joka yhdistää tilavuuden paineen P ja lämpötila T. N: n ja R: n arvot ovat vakioita: n on kaasun moolien lukumäärä ja r kaasuvakio. Isotermisen prosessin tapauksessa tuote PV se on vakio.
Voi palvella sinua: Antoine -vakiot: kaavat, yhtälöt, esimerkitNo, tehty työ lasketaan integroimalla pieni differentiaalityö, jossa voima F tuottaa pienen DX -siirtymän:
Dw = fdx = padx
Kuten ADX on juuri tilavuuden vaihtelu DV, niin:
Dw = pdv
Jotta voidaan saada kokonainen työ isotermisessä prosessissa, DW: n ilmaisu on integroitu:
Paine P ja tilavuus V Ne ovat kaaviota kaaviossa P-V Kuten kuviossa ja tehty työ vastaa käyrän alla olevaa aluetta:
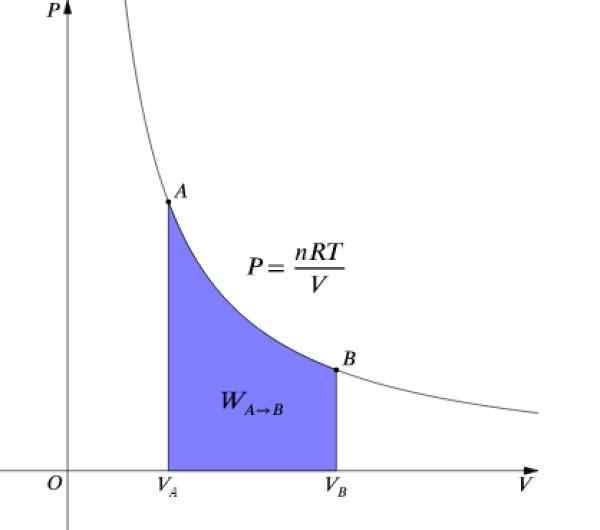 Kuva 4. P-V-kaavio isotermisestä prosessista. Lähde: Wikimedia Commons.
Kuva 4. P-V-kaavio isotermisestä prosessista. Lähde: Wikimedia Commons. Kuten ΔU = 0 Koska lämpötila pysyy vakiona, isotermisessä prosessissa sen on:
Q = W
- Harjoitus 1
Sylinteri, joka on varustettu liikkuvan männän kanssa, sisältää ihanteellisen kaasun 127 ºC: n nopeudella. Jos mäntä liikkuu, kunnes alkutilavuus vähenee 10 kertaa, pitämällä lämpötilavakio, etsi sylinterin sisältämien moolien määrä, jos kaasulla tehdyt työt ovat 38.180 J.
Tosiasia: R = 8.3 j/mol. K -k -
Ratkaisu
Lausunto vahvistaa, että lämpötila pysyy vakiona, niin olemme isotermisen prosessin läsnäollessa. Kaasulle tehdyssä työssä yhtälö on aiemmin vähennetty:

127 º C = 127 + 273 K = 400 K
N Selkeä, moolien lukumäärä:
N = w / rt ln (v2 / v1) = -38180 J / 8.3 j/mol.K X 400 K X LN (V2/10 V2) = 5 moolia
Negatiivinen merkki oli ennen työtä. Huomaavainen lukija on huomannut edellisessä osassa, että W määritettiin "järjestelmän tekemäksi työksi" ja jolla on merkki +. Joten "järjestelmässä tehdyssä työssä" on negatiivinen merkki.
Se voi palvella sinua: Toinen tasapainotila: Selitys, esimerkit, harjoitukset- Harjoitus 2
Sinulla on ilma sylinterissä, joka on varustettu männän kanssa. Alun perin niitä on 0.4 m3 paine 100 kPa ja 80 º C lämpötila. Ilma on pakattu 0: lla.1 m3 Varmista, että sylinterin lämpötila pysyy vakiona prosessin aikana.
Määritä, kuinka paljon työtä tehdään tämän prosessin aikana.
Ratkaisu
Käytämme yhtälöä aiemmin vähennettyyn työhön, mutta moolien lukumäärää ei tiedetä, mikä voidaan laskea ihanteellisten kaasujen yhtälöllä:
80 º C = 80 + 273 K = 353 K.
P1V1 = n.R -.T → n = p1V1 /RT = 100000 Pa x 0.4 m3 /8.3 j/mol. K X 353 K = 13.65 mol
W = n.R -.T ln (v2/V1) = 13.65 mol x 8.3 j/mol. K X 353 K X LN (0.1/0.4) = -55.442.26 J
Jälleen negatiivinen merkki osoittaa, että työ tehtiin järjestelmässä, mikä tapahtuu aina, kun kaasua on pakattu.
Viitteet
- Bauer, W. 2011. Fysiikka tekniikkaan ja tieteisiin. Osa 1. MC Graw Hill.
- Cengel, ja. 2012. Termodynamiikka. 7mehu Painos. McGraw Hill.
- Figueroa, D. (2005). Sarja: Tieteen ja tekniikan fysiikka. Osa 4. Nesteet ja termodynamiikka. Toimittanut Douglas Figueroa (USB).
- Ritari, r. 2017. Tutkijoiden fysiikka ja tekniikka: strategialähestymistapa.
- Serway, R., ULOLE, c. 2011. Fysiikan perusteet. 9naa Cengage -oppiminen.
- Wikipedia. Isoterminen prosessi. Haettu: vuonna.Wikipedia.org.
- « Acrilonitriilirakenne, ominaisuudet, tuotanto, käyttö
- Peräkkäiset lauseet mitkä ovat ja 75 esimerkkiä »


