Kiraalisuus
- 1398
- 82
- Ronald Reilly
 Kiraalisuus liittyy epäsymmetriaan ja tapahtuu, kun elementtiä ei voida asettaa peiliin peiliin. Lähde: Gabriel Bolívar
Kiraalisuus liittyy epäsymmetriaan ja tapahtuu, kun elementtiä ei voida asettaa peiliin peiliin. Lähde: Gabriel Bolívar Mikä on kiraalisuus?
Se kiraalisuus Se on geometrinen ominaisuus, jossa objektilla voi olla kaksi kuvaa: yksi oikea ja yksi vasemmalle, jotka eivät ole vaihdettavissa. Toisin sanoen ne ovat alueellisesti erilaisia, vaikka loput niiden ominaisuudet ovat identtisiä. Objekti, jolla on kiraalisuutta, sanotaan yksinkertaisesti, että se on "kirallinen".
Oikea ja vasen käsi.
Enemmän kuin peili, tietää, onko esine kiraalista, on esitettävä seuraava kysymys: Onko sinulla ”versioita” sekä vasemmalle että oikealle puolelle?
Esimerkiksi vasemman käsityön doppit ja toinen oikealle -oikealle ovat kiraalisia esineitä. Kaksi saman mallin ajoneuvoa, mutta ohjauspyörä vasemmalla tai oikealla, pari kenkiä, aivan kuten jalat. Etanan portaat vasempaan suuntaan ja oikeaan suuntaan jne.
Ja kemiassa molekyylit eivät ole poikkeus: ne voivat olla myös kiraalisia. Yläkuvassa esitetään pari molekyyliä tetraedrisen geometrian kanssa.
Vaikka vasen on käännetty ja sinisen ja violetin pallot, ruskea ja vihreä väri "näyttävät" ulos koneesta.
Kuinka määrittää molekyylin kiraalisuus?
Molekyylien kanssa ei ole niin yksinkertaista määritellä, mikä on vasen tai oikea "versio" vain katsomalla niitä.
Tätä varten orgaaniset kemikaalit turvautuvat Cahn-ingold-prelogin kokoonpanoihin (R) tai (S) tai perustuvat näiden kiraalisten aineiden optiseen ominaisuuteen polarisoituneen valon kiertämiseksi (joka on myös kiraalinen elementti).
Se voi palvella sinua: litium: historia, rakenne, ominaisuudet, riskit ja käytötEi kuitenkaan ole vaikea määrittää, onko molekyyli vai yhdiste kiraali vain tarkkailemalla sen rakennetta. Mitä silmiinpistävää erityistä ylemmän kuvan vääntömomenttia on?
Siinä on neljä erilaista substituenttia, jokaisella on oma ominaisuusväri, ja myös geometria keskusatomin ympärillä on tetraedrinen.
Jos rakenteessa on atomi, jolla on neljä erilaista substituenttia, voidaan vahvistaa (useimmissa tapauksissa), että molekyyli on kiraalinen.
Sitten sanotaan, että rakenteessa on kiraalisuuden keskipiste tai Stereogeeninen keskus. Missä on yksi, on pari stereoisomeeriä enantiomeerit.
Kuvan kaksi molekyyliä ovat enantiomeerejä. Mitä suurempi kiraalikeskusten lukumäärä, joilla on yhdiste, sitä suurempi sen alueellinen monimuotoisuus.
Keskusatomi on yleensä hiiliatomi kaikissa biomolekyyleissä ja yhdisteissä, joilla on farmakologinen aktiivisuus. Se voi kuitenkin olla myös fosfori, typpi tai metalli.
Esimerkkejä kiraalisuudesta
Kiraalikeskus on ehkä yksi tärkeimmistä osista määritettäessä, onko yhdiste kiraalista vai ei.
On kuitenkin muitakin tekijöitä, jotka voivat jäädä huomaamatta, mutta 3D -malleissa näyttää peilikuvan, jota ei voida päätellä.
Näille rakenteille sanotaan, että keskuksen sijasta heillä on muita kiraalisuuden elementtejä.
Tätä silmällä pitäen epäsymmetrisen keskuksen läsnäolo, jossa on neljä substituentti.
Se voi palvella sinua: sinkkihydroksidi (Zn (OH) 2)Aksiaali-
 Alenon ja bifenyyliyhdisteen rakenteet. Lähde: Wikimedia Commons
Alenon ja bifenyyliyhdisteen rakenteet. Lähde: Wikimedia Commons Yläkuvien yhdisteissä on esitetty, jotka saattavat tuntua tasaisilta paljaalle silmille, mutta ne eivät todellakaan ole.
Vasemmalla sinulla on alenon yleinen rakenne, jossa R tarkoittaa neljää eri substituenttia. Ja oikealla puolella bifenyyliyhdisteen yleinen rakenne.
Loppu, josta R löytyy3 ja r4 Se voidaan visualisoida ”eväksi” kohtisuoraan koneeseen, jossa he valehtelevat1 ja r2.
Jos tarkkailija analysoi tällaisia molekyylejä, jotka sijoittavat silmän ensimmäisen hiilen edessä1 ja r2 (Alenolle) näet r1 ja r2 vasemmalle ja oikealle puolelle ja r4 ja r3 ylös ja alas.
Kyllä r3 ja r4 Ne pysyvät kiinteinä, mutta r1 Ja r2 Vasemmalla puolella on toinen "avaruusversio".
Täällä tarkkailija voi päätellä, että hän löysi alenon kiraalisuuden akselin. Sama koskee bifenyyliä, mutta aromaattisten renkaiden kanssa.
Renkaat tai helikiyysruuvit
 Heptheliicenos -kiraalisuuden akseli. Lähde: Wikimedia Commons
Heptheliicenos -kiraalisuuden akseli. Lähde: Wikimedia Commons Huomaa, että edellisessä esimerkissä kiraalisuuden akseli makasi luuranko C = C = C, alenolle ja ar-ar-linkille bifenyylille.
Yllä oleville yhdisteille, nimeltään Hepthehelicenos (seitsemän renkaasta), sen kiraalisuuden akseli on z -akseli, potkuri.
Siksi, jotta voit erottaa toisen enantimeerin, sinun on tarkkailtava näitä molekyylejä ylhäältä (mieluiten).
Tällä tavalla voidaan yksityiskohtaisesti, että heptheliicen pyörii kelloleulojen suuntaan (kuvan vasen puoli) tai antihorariumin suuntaan (kuvan oikea puoli).
Voi palvella sinua: natriumhydroksidi (NaOH): rakenne, ominaisuudet, käytöt, synteesiSuunnitelma
Oletetaan, että helicenusta ei enää ole, vaan molekyyli, jossa ei ole keinoplaanirenkaita, ts. Yksi on toisen ylä- tai alapuolella (tai eivät ole samassa tasossa).
Täällä kiraalinen hahmo ei lepää niin paljon renkaassa, vaan sen substituenteissa, koska juuri nämä määrittelevät molemmat kaksi enantiomeeria.
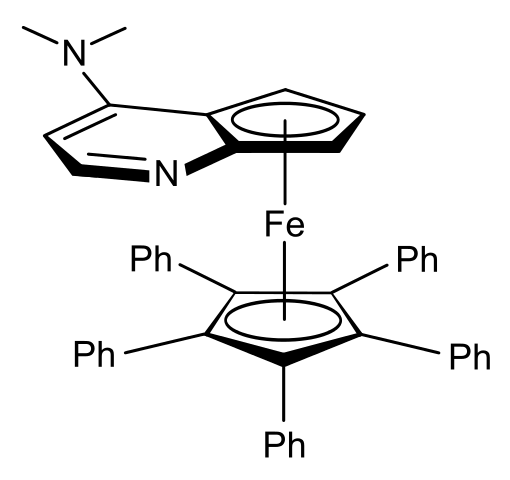
 Tasomainen kiraalisuus. Lähde: Wikimedia Commons
Tasomainen kiraalisuus. Lähde: Wikimedia Commons Esimerkiksi ylemmän kuvan ferroenissa sinulla on, että uskon atomi "upottavat" eivät muutu, vaan renkaan alueellinen suunta typpiatomilla ja ryhmällä -N (CHO (valitse3-A2.
Kuvassa ryhmä -n (CHO3-A2 osoittaa vasemmalle, mutta enantiómerossa se osoittaa oikealle.
Toiset
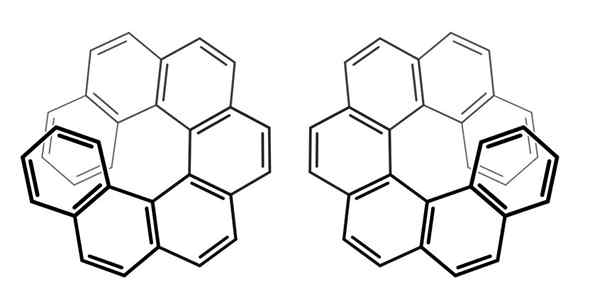
Makromolekyyleille tai ainutlaatuisilla rakenteilla oleville panoraama alkaa yksinkertaistaa. Tämä johtuu siitä, että 3D -malleistaan voit nähdä lintulennon, jos ne ovat kiraalisia vai eivät, kuten alkuperäisten esimerkkien kohteiden kanssa.
Esimerkiksi hiilinanoputki voi näyttää käännökset vasemmalle, ja siksi se on kiraalinen, jos on identtinen, mutta käännökset oikealle.
Sama pätee muihin rakenteisiin, joissa ei ole kiraalisuuden keskuksia huolimatta kaikkien sen atomien alueellisesta asennuksesta voi omaksua kiraalisia muotoja.
Sitten puhutaan luontaisesta kiraalisuudesta, joka ei riipu atomista, vaan koko sarjasta.
Kemiallisesti voimakas muoto "vasemman kuvan" erottamiseksi oikealta on stereoselektiivisen reaktion kautta, ts. Missä se voi kulkea vain enantiomeerin kanssa, kun taas toisen kanssa ei.
Viitteet
- Kiraalisuus (kemia). Haettu jstk.Wikipedia.org
- Kiristyminen. Kemia.com

