Rakenteen radio, ominaisuudet, käyttö, hankkiminen
- 2512
- 691
- Gabriel Fahey
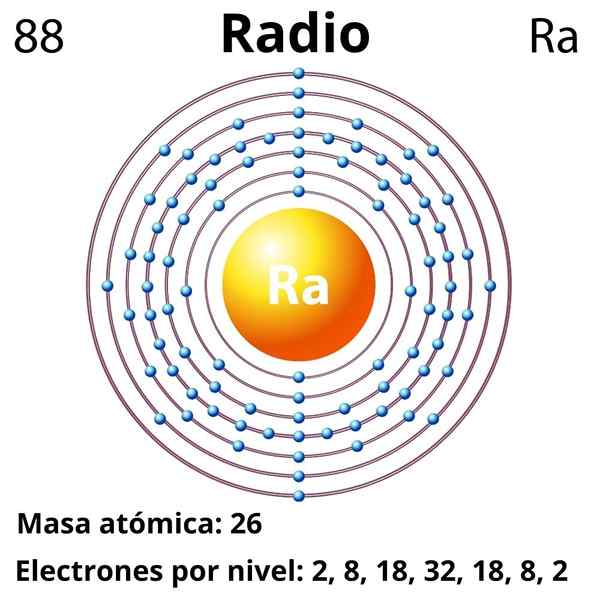
Hän radio Se on metallielementti, joka kuuluu jaksollisen taulukon ryhmään 2, alkalinottimeen metalleihin, joiden kemiallinen symboli on RA. Se on tämän ryhmän viimeinen jäsen, joka sijaitsee bariumin alapuolella, ja edeltävät radioaktiiviset elementit, kuten torium ja uraani; Säde on kuitenkin noin miljoona kertaa radioaktiivisempi ja siksi vaarallisempi kuin itse uraani.
Se on elementti, jota ympäröivät uskomattomat ja valittavat tarinat, kaikki sen kielteisten vaikutusten tietämättömyyden seurauksena terveyteen. Heidän suolojensa ja vesipitoisten ratkaisujensa sinertävän kirkkauden Pierre ja Marie Curie, jotka löysivät sen vuonna 1898 analysoimalla selittämätöntä ja voimakasta säteilyä Pechblenda -malmin näytteistä, joihin heidän uraanin ja uraanin sisältö olivat poistaneet heidän uraanipitoisuuden ja sisällön ja sisällönsä ja sisällönsä ja sisällönsä ja sisällönsä ja poloni.
 Radion löytäjä Marie Curien kuva
Radion löytäjä Marie Curien kuva Pechblendassa oli uraania ja poloniumia, Curie ja päätteli, että voimakkaasta säteilystä oli toinen elementti. Tämä uusi elementti oli kemiallisesti hyvin samanlainen kuin Barium; Toisin kuin sen spektrivihreät viivat, tämän viivat olivat kuitenkin karmiinien väriä.
Siten he saivat 0 prechblendan prosessoinnin, puhdistamisen ja analysoinnin jälkeen 0.1 mg raclia2. Siihen mennessä, vuonna 1902, he olivat jo määrittäneet radion atomimassan, jonka nimi on johdettu latinalaisesta sanasta 'säde', mikä tarkoittaa 'Ray'. Radio on kirjaimellisesti säteilevä elementti.
Kahdeksan myöhemmin, vuonna 1910, Marie Curie yhdessä ranskalaisen kemistin André Louis Debiernen kanssa onnistui eristämään säteen metallimuodossaan racl -elektrolyysillä2 Elohopean käyttäminen. Tutkimuskuume syntyi, josta tuli myöhemmin hälyttävä kaupallinen, kulttuuri- ja lääketieteellinen sensaatio.
[TOC]
Rakenne
Radio on metalli, jonka atomit ovat hyvin tilaa vieviä. Tämän seurauksena heidän kiteitään on vähän tiheää (vaikkakin hieman enemmän kuin Bario), ja omaksuvat kehon (BCC) keskittyneen kuutiometrin rakenteen (BCC). Tämän rakenteen ulkopuolella ei ole muuta lämpötiloja tai paineita.
Elektroninen kokoonpano

Radion elektroninen kokoonpano on seuraava:
[RN] 7s2
Se hapettaa valtavasti helposti tulla kationiksi2+, joka on isolektroninen jalo -radonikaasusta. Siksi kaikki sädeyhdisteet sisältävät kationin RA: n2+, pääosin ionisten vuorovaikutusten luominen; On kuitenkin arvioitu, että on mahdollista, että relativististen vaikutusten vuoksi se voi muodostaa yhteyksiä huomattavaan kovalenttiseen luonteeseen (RA-X).
Voi palvella sinua: kaliumbentsoaatti: rakenne, ominaisuudet, hankkiminen, käyttöRadioominaisuudet
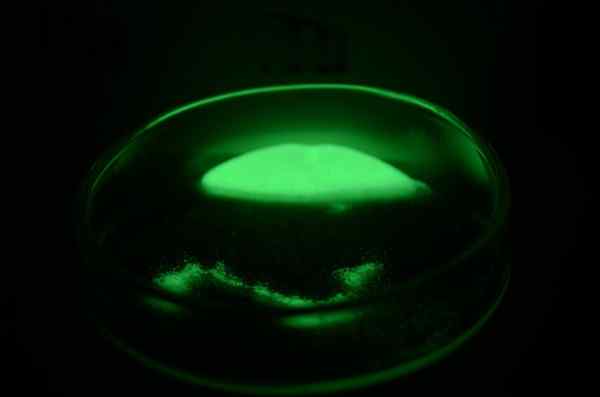 Radioyhdistelysnäyte
Radioyhdistelysnäyte Fyysinen ulkonäkö
Radio on hopeavalkoinen metalli, joka värjää välittömästi keltaiseksi ja tummenee reagoidessaan typen kanssa ilmasta sen nitruron, RA: n muodostamiseksi3N2. Koska on niin vaikeaa manipuloida, säde on vähän fyysisiä ominaisuuksia, jotka on määritetty suoraan.
Atominumero
88
Moolimassa
226.03 g/mol
Sulamispiste
Noin 700 ºC. Tätä suuruutta ei ole pystynyt määrittämään tarkalleen.
Kiehumispiste
Radio kiehuu välillä 1100 - 1700 ºC. Tämä suuri epätarkkuusmarginaali heijastaa jälleen kerran epävakaan metallin manipuloinnin komplikaatioita.
Tiheys
5.5 g/cm3
Sulamislämpö
8.5 kJ/mol
Höyrystyslämpö
113 kJ/mol
Hapetustila
Radiossa on yksi +2 hapettumistila.
Elektronegatiivisuus
0 -.9. Tämä arvo vastaa uskollisesti säteen voimakasta elektropositiivista luonnetta.
Ionisaatioenergiat
Ensimmäinen: 509.3 kJ/mol
Toinen: 979 kJ/mol
Radioaktiivisuus
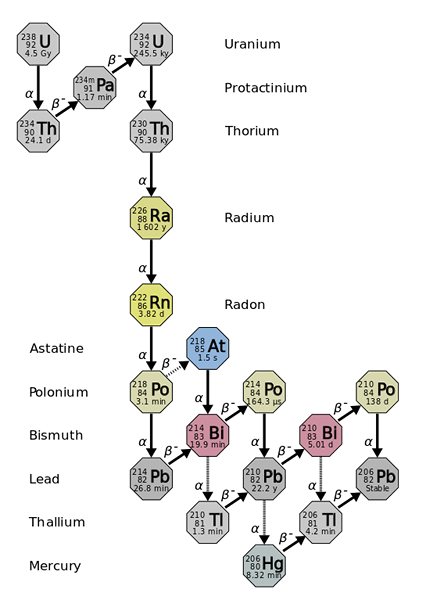 Säde on peräisin raskaampien ja epävakaampien elementtien radioaktiivisista vähenemisistä, kuten uraani-238 isotooppi. Lähde: Käyttäjä: Tosaka, CC 3: lla.0, Wikimedia Commons
Säde on peräisin raskaampien ja epävakaampien elementtien radioaktiivisista vähenemisistä, kuten uraani-238 isotooppi. Lähde: Käyttäjä: Tosaka, CC 3: lla.0, Wikimedia Commons Säde on noin miljoona kertaa radioaktiivisempi kuin uraani. Tämä johtuu pääasiassa siitä, että siitä tuotetaan muita isotooppeja, kuten 222RN (ylivoimainen kuva), joka puolestaan hajoaa lähettämällä a -hiukkaset transformiksi isotooppiksi 218Poikki. Radionäyte antaa siis suuria määriä a- ja β -hiukkasia-, samoin kuin γ -säteet.
Esimerkiksi gramma radio kärsii 3.7 · 1010 Hajoamiset sekunnissa, mitta, joka määritteli CI -yksikön, nimeltään Curie. Tämä energia riittää lämmittämään 25 gramman vettä 1 ° C tunnissa.
Jos rappeutumisketjua havaitaan, nähdään, että alkuperäinen isotooppi, 238U, sinulla on a t1/2 4.5 Giga -vuotta (miljardeja vuosia); sen sijaan 226RA: lla on a t1/2 1600 vuotta, joka tuottaa myös isotooppeja t1/2 vain päivistä, minuutteista ja sekunnista.
Radion ja sen yhdisteiden radioaktiivisuus on ionisoiva, joten fluoresoivat aineet, jopa ympäröivät atomit, syttyvät yön aikana, kykenevän laukaisemaan räjähtäviä reaktioita. Tämä ominaisuus tunnetaan radioluminesenssina.
Yhdisteet ja reaktiivisuus
Kun suoloja tai radioyhdisteitä lämmitetään kevyemmällä, ne ampuvat karmiinin liekin. Tällaiset kiinteät aineet ovat yleensä valkoisia tai värittömiä, mutta ne ovat värjätty keltaisia ja lopulta tummuvat radioatomien radioaktiivisuuden seurauksena. Jos heillä on bariumin epäpuhtauksia, he voivat näyttää vaaleanpunaisia sävyjä.
Voi palvella sinua: kaksinkertainen korvausreaktioRadiokemia on hyvin samanlainen kuin Bario, ikään kuin he olisivat kaksi erottamatonta veljeä, Ra-ba. Molemmat muodostavat samat suolat, liukenemattomat veteen, erolla, että säteen suolat ovat hiukan liukenemattomia. Esimerkiksi radiosulfaatti, satiini4, Se on liukenemattomampaa kuin bariumsulfaatti, baso4; Itse asiassa se on kaikkien aikojen liukenemattomin sulfaatti: 2.1 mg siitä liukenee vain 1 litraa vettä.
Toisaalta radiohydroksidi, RA (OH)2, Se on kaikkien ikäisensä hydroksidien liukoisin ja emäksisin.
Liuoksessa, Ratines2+, Sen sijaan, että käyttäytyisivät kuin Lewis -hapot, ne ovat emäksiä, koska niiden suuri koko tekee siitä mahdotonta molekyyleille.
Radion ja bariumin välinen kemiallinen analogia palaa tähän metalliin, joka on vaikea erottaa, koska sen suolat todistavat bariumin kanssa.
Radio käyttää/sovelluksia
Valokellot
 Valaisevat ja fosforoivat kellot olivat erittäin toivottuja 1800 -luvulla, visuaalisen houkuttelevuuden vuoksi ja arvostetun radion sisällyttämiseksi heidän maalauksissaan. Lähde: Ase95, CC BY-SA 3.0, Wikimedia Commons
Valaisevat ja fosforoivat kellot olivat erittäin toivottuja 1800 -luvulla, visuaalisen houkuttelevuuden vuoksi ja arvostetun radion sisällyttämiseksi heidän maalauksissaan. Lähde: Ase95, CC BY-SA 3.0, Wikimedia Commons Säteen suosituinta ja kiistanalaista käyttöä oli tarkoitus käyttää lisäaineena kellojen maalauksille. Sen atomit sisällytettiin sinkkisulfidin, ZNS: n tahmeihin formulaatioihin, jotka imevät radioaktiiviset päästöt vihreän ja fosforoivan valon vapauttamiseksi. Maali levitettiin kellon käsiin (ylivoimainen kuva).
Tämän käytön ongelma oli jatkuvassa radioaktiivisessa valotuksessa, joka vaikutti näiden kellojen käyttäjiin; Tai mikä pahempaa, työntekijöille, jotka maalasivat heidät tehtaisiin.
Vuonna 1924 useat maaliteollisuudessa työskentelevät työntekijät, jotka tunnetaan myöhemmin nimellä Radio Girls (radium -tytöt), alkoivat kärsiä luusyövästä, leukojensa muodonmuutoksista ja hampaiden menetyksistä, koska heidän piti nuolla kärki harjoistasi olla Pystyy levittämään radioaktiivista maalia kelloihin.
Tämä sekä säteen tietämättömyys ja työntekijöiden turvallisuuden takaavien suojatoimenpiteiden asettamatta jättämisen vähäiset etiikat päättyivät oikeudelliseen skandaaliin, joka mullisti työturvallisuuslakeja.
Voi palvella sinua: vuokraa halogeenuros: ominaisuudet, hankkiminen, esimerkkejäRadiomaalaukset lakkasivat valmistusta vuonna 1960; Vaikka tänään on useita keräilynäytteitä, joilla se on pinnoillaan.
Raditri
 Radithor -pullo, joka on esitelty kansallisessa ydintieteiden ja historian museossa, New Mexico. Lähde: Sam Larussa yhdysvalloista Amerikasta, CC BY-SA 2.0, Wikimedia Commons
Radithor -pullo, joka on esitelty kansallisessa ydintieteiden ja historian museossa, New Mexico. Lähde: Sam Larussa yhdysvalloista Amerikasta, CC BY-SA 2.0, Wikimedia Commons Radithor oli yksi monista lääke- ja kosmeettisista tuotteista, jotka julistivat radiotehokkuuden taistellakseen tuhannen ja yhden sairaan kanssa. Se sisälsi mikrometrisen radiomäärän, joka sen pitäisi parantaa kaikkia ruoansulatus- ja endokriinisiä sairauksia. Radithor lähti markkinoilta vuonna 1932 sen jälkeen, kun Eden Byers, joka on yksi sen kiihkeimmistä kuluttajista.
Sädehoito
Kaikki radiokäytöt eivät olleet sensaatiomaisia, pseudotieteellisiä ja häikäilemättömiä (tai rikollisia). Terveydelle oli myös todella hyödyllistä ainakin jonkin aikaa. Radiosuolat, racl2 ja Rab2, Niitä käytetään syöpähoidossa, erityisesti luisyövässä.
Isotooppi 223RA, kun aineenvaihdunnan kalsiumioulit hämmentyvät, lopulta tuhoaa luussa sijaitsevat syöpäsolut.
Monet säteen terapeuttiset käytöt on kuitenkin korvattu turvallisemmilla, taloudellisilla ja tehokkailla isotoopeilla, kuten 60 60CO ja 137CS.
Saada
Radio on yksi niistä elementeistä, joiden tuotanto on vähän: vain noin 100 grammaa vuodessa maailmanlaajuisesti. Tonnia uraani -appelsiinia, kuten Pechblenda (tai Uraniniitti) -malmia4-Baso4.
Satiiniseos4-Baso4 Se muutettiin heidän klorideiksi, racl2-Bacl2, Kationien erottaminen RA2+ fraktionaalisilla kiteytyksillä ja lopulta puhdistamalla ionisia kromatografiatekniikoita. Racl2 Sitä pienenee elektrolyysillä tai vähentämällä sitä metallisella alumiinilla 1200 ºC: iin.
Isotoopit
Kaikki radio -isotoopit ovat radioaktiivisia. Niistä neljä on luonteeltaan atomien radioaktiivisen rappeutumisen tuotteita 232Th, 235U ja u ja 238TAI.
Nämä neljä isotoopia ovat: 223RA (t1/2= 11.4 päivää), 224RA (t1/2= 3.64 päivää), 226RA (t1/2= 1600 vuotta) ja 228RA (5.75 vuotta). On selvää, että melkein kaikki radiotomit koostuvat isotooppiseoksista 226Ra ja 228Ra, koska muut hajoavat nopeasti.
Hän 226RA on vakain kaikista radion isotoopeista, kaikki muut ovat liian epävakaita, t1/2 Alle kaksi tuntia.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Wikipedia. (2020). Radium. Haettu: vuonna.Wikipedia.org
- Enyclopaedia Britannica -toimittajat. (2020). Radium. Toipunut: Britannica.com
- Radioaktiivisuus. (S.F.-A. Radium: radioaktiivinen ydin, joka teki historiaa. Palautettu: radioaktiivisuus.EU.com
- Cantrill, v. (2018). Radiumin todellisuudet. Luonnon kemia 10, 898. doi.org/10.1038/S41557-018-0114-8
- Elsevier B.V. (2020). Radium. Tiede. Haettu: ScienEdirect.com
- « Tuulen eroosiotekijät, tyypit, seuraukset, esimerkit
- Kursivoidun niemimaan maantiede, maat, kasvisto, eläimistö, ilmasto »

