Enderoninen reaktio

- 4580
- 190
- Mr. Clifford Kshlerin
 Endary -reaktio on, että ei -spontaani ja se vaatii paljon energiaa
Endary -reaktio on, että ei -spontaani ja se vaatii paljon energiaa Mikä on päättyvä reaktio?
Eräs Enderoninen reaktio Se ei ole spontaani ja vaatii myös korkean energian tarjonnan. Kemiassa tämä energia on yleensä kalori. Kaikista endotermisistä reaktioista tunnetuimpia ovat endotermiset reaktiot, toisin sanoen ne, jotka absorboivat lämpöä.
Syy siihen, miksi kaikki reaktiot eivät ole spontaaneja, johtuu siitä, että ne kuluttavat energiaa, ja kyseisten lajien muodostamat järjestelmät vähentävät niiden entropiaa. Toisin sanoen kemiallisiin tarkoituksiin niistä tulee molekyylisempi.
Tiiliseinän rakentaminen on esimerkki pääaarisesta reaktiosta. Pelkästään tiilet eivät ole riittävän kompakteja kiinteän rungon muodostamiseksi. Tämä johtuu siitä, että sen liitosta ei ole energiavahvistusta (heijastuu myös sen mahdollisissa matalissa molekyylien välisissä vuorovaikutuksissa).
Seinän rakentamiseksi tarvitset sementtiä ja työtä. Tämä on energiaa, ja ei -esto -reaktio (seinä ei rakenneta automaattisesti) on mahdollista, jos energiaetu havaitaan (taloudellinen, seinän tapauksessa).
Jos hyötyä ei ole, seinä romahtaa mihin tahansa häiriöön, ja niiden tiilet eivät voi koskaan pysyä yhtenäisinä. Sama koskee monia kemiallisia yhdisteitä, joiden rakennuslohkot eivät voi liittyä spontaanisti.
Päättyneen reaktion ominaisuudet
- Se ei ole spontaani.
- Imeä lämpöä (tai muun tyyppistä energiaa).
Syynä on, että heidän tuotteillaan on enemmän energiaa kuin reagointiin liittyvät reagenssit. Yllä olevaa voidaan esitellä seuraavalla yhtälöllä:
ΔG = gTuotteet-GReagenssit
Missä ΔG on Gibbsin vapaan energian muutos. Gr: nTuote on suurempi (koska se on energisempi) kuin GReagenssit, Vähennys on oltava suurempi kuin nolla (ΔG> 0). Seuraava kuva on yhteenveto äskettäin selitetystä:
Voi palvella sinua: natriumsulfaatti (Na2SO4): rakenne, ominaisuudet, käyttötarkoitukset, hankkiminen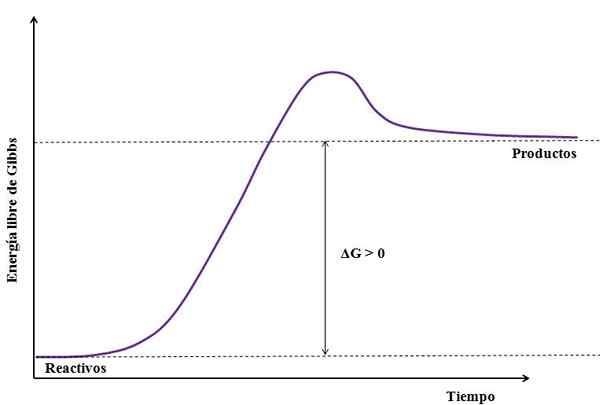 Endergisen reaktion kuva. Lähde: Gabriel Bolívar
Endergisen reaktion kuva. Lähde: Gabriel Bolívar Huomaa energiatilojen välinen ero tuotteiden ja reagenssien välillä (violetti viiva). Siksi reagenssit eivät muutu tuotteiksi (A+B => C), jos ensin ei ole lämmön imeytymistä.
Lisää vapaata energiaa
Jokaisella endergonisella reaktiolla on järjestelmävapaa energiaa lisääntynyt. Jos tietylle reaktiolle toteutetaan, että ΔG> 0, niin se ei ole spontaani ja vaatii suoritettavan energian tarjonnan.
Kuinka tietää matemaattisesti, onko reaktio endegonic vai ei? Seuraavan yhtälön soveltaminen:
ΔG = ΔH-TδS
Jos ΔH on reaktion entalpia, toisin sanoen kokonaisenergia vapautuu tai imeytyy, ΔS on entropian muutos ja t lämpötila. TδS -tekijä on energian menetys.
Siten ΔG on energia, jota järjestelmä voi käyttää työn suorittamiseen. Koska ΔG: llä on positiivinen merkki pääaarisesta reaktiosta, tuotteiden saamiseksi on käytettävä energiaa tai työtä (reagensseja).
Joten, kun tiedät ΔH -arvot (positiiviset, endotermiselle reaktiolle ja negatiiviseksi eksotermisen reaktion suhteen) ja TδS: lle, voit tietää, onko reaktio loppua -gononic.
Tämä tarkoittaa, että vaikka reaktio on endoterminen, Ei Se on välttämättä endogonista.
Jääkuutio
Esimerkiksi jääkuutio sulaa nestemäisessä veden absorboivassa lämmössä, mikä auttaa erottamaan sen molekyylit; Prosessi on kuitenkin spontaani, ja siksi se ei ole päättyy reaktio.
Jos jää on perustettu lämpötilassa, joka on selvästi alle -100 ° C, vapaan energiayhtälön termi TAS tulee pieneksi verrattuna ΔH: een (koska t pienenee), ja seurauksena ΔG: llä on positiivinen arvo.
Voi palvella sinua: karboksyylihappoToisin sanoen: Sulata jää alle -100 ° C on endegonic -prosessi, eikä se ole spontaani. Samanlainen tapaus on veden jäädyttäminen noin 50 ° C: ssa, mikä ei tapahdu spontaanisti.
Heidän tuotteidensa yhteydet ovat heikompia
Toinen tärkeä ominaisuus, joka liittyy myös ΔG: hen, on uusien linkkien energia. Muodostuneiden tuotteiden yhteydet ovat heikompia kuin reagenssien linkit.
Linkkien voiman väheneminen kompensoidaan kuitenkin massan vahvistuksella, mikä heijastuu fysikaalisiin ominaisuuksiin.
Tässä vertailu tiiliseinään alkaa menettää merkitystä. Edellä esitetyn mukaan tiilien sisällä olevien tankojen on oltava vahvempia kuin niiden ja sementin välillä. Seinä kokonaisuutena on kuitenkin jäykempi ja kestävämpi saada suurempi massa.
Se on kytketty eksergonisiin reaktioihin
Jos loppupäästöreaktiot eivät ole spontaaneja, miten ne tapahtuvat luonnossa? Vastaus johtuu kytkemisestä muiden reaktioiden kanssa, jotka ovat melko spontaaneja (eksergonisia) ja jotka jotenkin edistävät niiden kehitystä.
Esimerkiksi seuraava kemiallinen yhtälö edustaa tätä pistettä:
A + B => C (Enderoninen reaktio)
C + D => E (Exergoninen reaktio)
Ensimmäinen reaktio ei ole spontaani, joten luonnollisesti sitä ei voinut tapahtua. C: n tuotanto sallii kuitenkin toisen reaktion tapahtua, aiheuttaen ja.
Gibbs -vapaiden energioiden lisääminen kahdelle reaktiolle, ΔG1 ja ΔG2, Tulos vähemmän kuin nolla (ΔG<0), entonces el sistema presentará un incremento de la entropía y, por lo tanto, será espontáneo.
Se voi palvella sinua: hydroritJos C ei reagoi D: n kanssa, en voinut koskaan muodostaa sitä, koska minulla ei ole energiakorvausta (rahan tapaus tiiliseinässä). Sitten sanotaan, että C ja D "Jalan" A ja B reagoida, jopa endegonic -reaktio.
Esimerkkejä endergonisista reaktioista
Fotosynteesi
Kasvit käyttävät aurinkoenergiaa hiilihydraattien ja hapen luomiseen hiilidioksidista ja vedestä. Co₂ ja o2, Pienet molekyylit, joissa on voimakkaita linkkejä, muodostavat sokereita, tervarakenteita, jotka ovat raskaampia, kiinteitä ja sulavat lämpötilassa noin 186º C.
Huomaa, että C-C-, C-H- ja C-O-linkit ovat heikompia kuin O = C = O ja O = O. Ja sokeriyksiköstä kasvi voi syntetisoida polysakkarideja, kuten selluloosa.
Biomolekyylien ja makromolekyylien synteesi
Endermaniset reaktiot ovat osa anabolisia prosesseja. Kuten hiilihydraatit, muut biomolekyylit, kuten proteiinit ja lipidit, vaativat monimutkaisia mekanismeja, jotka ilman niitä, ja kytkemällä ATP: n hydrolyysireaktio.
Timanttien ja raskaiden raakayhdisteiden muodostuminen
Timantit vaativat valtavia paineita ja lämpötiloja, jotta niiden komponentit voivat kompakti kiteisen kiinteän aineen.
Jotkut kiteytykset ovat kuitenkin spontaaneja, vaikka ne kulkevat erittäin hitaasti (spontaanisuus ei liity reaktion kinetiikkaan).
Lopuksi, raakaöljy yksin edustaa enderonisten reaktioiden, erityisesti raskaita hiilivetyjä tai makromolekyylejä, nimeltään asfaltens.
Niiden rakenteet ovat erittäin monimutkaisia, ja niiden synteesi tarvitsevat paljon aikaa (miljoonia vuosia), lämpöä ja bakteeria.
Muita esimerkkejä
- Kasvien solujen hengitys.
- Hapen kuljetus verenkiertoon.
- Ionien diffuusio solukalvojen kautta.
- Lihassupistus.
- Soluproteiinisynteesi.
Viitteet
- Endermaniset ja exeroniset reaktiot. Toipunut Quimitubesta.com
- Ilmaista energiaa. ES: stä palautettu.Khanacademy.org
- Endergonisen reaktion määritelmä. Biologiasta haettu.netto

