Exergoniset reaktioominaisuudet ja esimerkit

- 2609
- 398
- Shawn Stanton II
Eräs exergoninen reaktio Se tapahtuu spontaanisti ja siihen liittyy yleensä energian vapautuminen joko lämmön, valon tai äänen muodossa. Kun lämpö vapautuu, sanotaan, että meillä on eksoterminen ja eksergoninen reaktio.
Siksi 'eksoterminen' ja 'exergoniset' termit ovat hämmentyneitä, ja ne käsitellään virheellisesti synonyymeinä. Tämä johtuu siitä, että monet eksotermiset reaktiot ovat myös eksergonisia. Siksi, jos havaitaan suuri lämmön ja valon irrottaminen, kuten tulipalon alkuperä, voidaan olettaa, että se koostuu eksergonisesta reaktiosta.
 Puun palaminen on esimerkki eksotermisestä ja samalla exergoninen reaktio. Lähde: Pixnio.
Puun palaminen on esimerkki eksotermisestä ja samalla exergoninen reaktio. Lähde: Pixnio. Vapautuva energia voi kuitenkin jäädä huomaamatta eikä ole niin yllättävää. Esimerkiksi nestemäinen väliaine voi kuumentua hiukan ja silti olla seurausta eksergonisesta reaktiosta. Joissakin eksergonisissa reaktioissa, jotka kulkevat liian hitaasti, alhaisin lämpötilan nousua ei edes havaittu.
Tämän tyyppisten termodynaamisten reaktioiden keskus- ja ominaispiste on Gibbs -vapaan energian väheneminen tuotteissa reagenssien suhteen, mikä tarkoittaa spontaanisuutta.
[TOC]
Exergonisten reaktioiden ominaisuudet
Yleinen kaavio
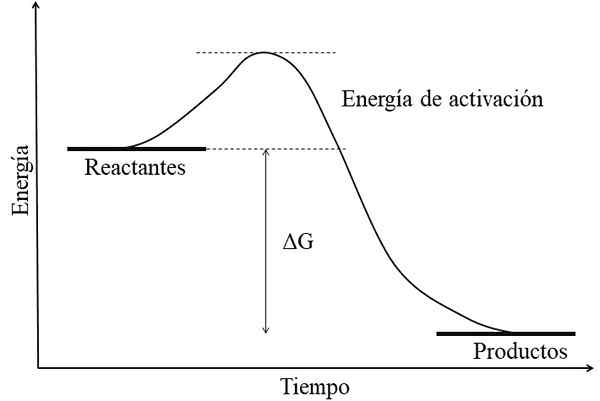 Energiakaavio eksergonista reaktiota varten. Lähde: Gabriel Bolívar.
Energiakaavio eksergonista reaktiota varten. Lähde: Gabriel Bolívar. Exergonisen reaktion pääominaisuus on, että tuotteiden GIBS: ien vapaat energiat ovat alhaisemmat kuin reagenssien tai reagenssien (ylivoimainen kuva). Tämä tosiasia liittyy yleensä tuotteisiin, jotka ovat kemiallisesti vakaampia, vahvempia linkkejä, dynaamisempia rakenteita tai "mukavampia" olosuhteita.
Siksi tämä energiaero, ΔG, on negatiivinen (AG < 0). Al ser negativa, la reacción en teoría debe ser espontánea. Sin embargo, otros factores también definen dicha espontaneidad, como lo son la energía de activación (la altura de la colina), la temperatura, y los cambios de entalpía y entropía.
Voi palvella sinua: homogeeninen järjestelmäKaikki nämä muuttujat, jotka reagoivat ilmiön luonteeseen tai tarkasteltavaan kemialliseen reaktioon, sallivat määrittää, onko reaktio exergoninen vai ei. Ja myös nähdään, että sen ei välttämättä tarvitse olla eksoterminen reaktio.
Kun aktivointienergia on erittäin korkea, reagenssit vaativat katalysaattorin apua mainittua energiaesteen vähentämiseksi. Siksi on olemassa eksergonisia reaktioita, jotka annetaan erittäin alhaisella nopeudella tai joita ei ole ollenkaan.
Ilmainen energian väheneminen järjestelmässä
Seuraava matemaattinen ilmaisu kattaa sen, mitä edellä kommentoidaan:
ΔG = ΔH - TδS
Termi ΔH on positiivinen, jos se on endoterminen reaktio, ja negatiivinen, jos se on eksoterminen. Jos haluamme ΔG: n olevan negatiivinen, termin Tδ: n on oltava erittäin suuri ja positiivinen, joten myös ΔH: n vähennettäessä operaation tulos on negatiivinen.
Siksi, ja tämä on toinen eksergonisten reaktioiden erityisominaisuus: ne merkitsevät suurta muutosta järjestelmän entropiassa.
Siten ottaen huomioon kaikki ehdot, voimme olla läsnä ennen eksergonista reaktiota, mutta samalla endotermisiä; eli ΔH -positiivisella, erittäin korkea lämpötila tai suuren entropian muutos.
Useimmat eksergoniset reaktiot ovat myös eksotermisiä, koska jos ΔH on negatiivinen, ja vähentämällä vielä vielä enemmän negatiivista termiä, meillä on siten ΔG, jolla on negatiivinen arvo; Ellei TδS ole negatiivinen (entropia laskeutuu), ja siksi eksoterminen reaktio tulee endogoniseksi (ei spontaanille).
On tärkeää korostaa, että reaktion spontaanisuus (olipa ne exergonista vai ei), riippuu suuresti termodynaamisista olosuhteista; Vaikka nopeus, jolla se kulkee, johtuu kineettisistä tekijöistä.
Se voi palvella sinua: Elävä aine: Konsepti, ominaisuudet ja esimerkitExergonisen reaktion spontaanisuus
Se mitä on sanottu, tunnetaan, koska eksergoninen reaktio on spontaani, onko eksoterminen. Esimerkiksi yhdiste voi liuottaa vettä jäähdyttämään sen astiansa kanssa. Tämä liukenemisprosessi on endoterminen, mutta kun se tapahtuu spontaanisti, sanotaan, että se on eksergoninen.
Eksoterminen reaktio
Reaktioita on enemmän kuin muut. Saadaksesi selville, seuraavan lausekkeen tulisi olla käsillä:
ΔG = ΔH - TδS
Exergonisimmat reaktiot ovat niitä, jotka annetaan spontaanisti kaikille lämpötiloille. Toisin sanoen riippumatta T: n arvosta edellisessä ekspressiossa, ΔH on negatiivinen ja ΔS -positiivinen (ΔH 0). Siksi ne ovat hyvin eksotermisiä reaktioita, jotka eivät ole ristiriidassa alkuperäisen idean kanssa.
Voi olla myös eksotermisiä reaktioita, joissa järjestelmän entropia pienenee (ΔS < 0); tal como sucede en la síntesis de macromoléculas o polímeros. En este caso, son reacciones exergónicas solamente a bajas temperaturas, ya que de lo contrario el término TΔS sería muy grande y negativo.
Endoterminen reaktio
Toisaalta on reaktioita, jotka ovat vain spontaaneja korkeissa lämpötiloissa: kun ΔH on positiivinen ja ΔS -positiivinen (ΔH> 0 ja ΔS> 0). Puhumme endoterisista reaktioista. Siksi lämpötilan laskeutumiset voivat tapahtua spontaanisti, koska niillä on entropian lisääntyminen.
Samaan aikaan on reaktioita, jotka eivät ole ollenkaan eksergonisia: kun ΔH: lla ja ΔS: llä on positiivisia arvoja. Tässä tapauksessa, riippumatta lämpötilasta, reaktio ei koskaan tapahdu spontaanisti. Puhumme silloin pääty -spantaanista päättymisreaktiosta.
Voi palvella sinua: hajauttamisvaiheEsimerkkejä eksergonisista reaktioista
Kemialle on yleensä ominaista räjähtävä ja loistava, joten oletetaan, että suurin osa reaktioista on eksotermisiä ja eksergisiä.
Palamiset
Exergoniset reaktiot ovat alkaanien, olefiinien, aromaattisten hiilivetyjen, sokerien jne. Palat.
Metallioksidi
Samoin metallien hapet ovat eksergonisia, vaikka ne kulkevat hitaammin.
Organismin kataboliset reaktiot
On kuitenkin myös muita hienovaraisempia prosesseja, jotka ovat myös eksergonisia ja erittäin tärkeitä: aineenvaihduntamme kataboliset reaktiot. Täällä makromolekyylit hajoavat, jotka toimivat energiasäiliöinä, vapauttaen itsensä lämmössä ja ATP: ssä ja jonka keho suorittaa monia sen toimintoja.
Näistä reaktioista symbolismin on solujen hengitys, vastapäätä fotosynteesiä, jossa happea hiilihydraatit "poltetaan" niiden muuttamiseksi pieniksi molekyyleiksi (CO2 ja h2O) ja energia.
Toiset
Muiden eksergonisten reaktioiden joukossa meillä on typen triayoduron räjähtävä hajoaminen tai3; veden alkalimetallien lisääminen, jota seuraa räjähdys; etoksyloitujen hartsien polymeerisynteesi; happo-emäs neutraloinnit vesiliuoksessa; ja luminesoivat kemotereaktiot.
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Walter J. Moore. (1963). Fysikaalinen kemia. Kemiallisessa kinetiikassa. Neljäs painos, Longmans.
- Iranin. Levine. (2009). Fysikaalis -periaatteet. Kuudes painos, sivu 479-540. MC Graw Hill.
- Wikipedia. (2020). Exergoninen reaktio. Haettu: vuonna.Wikipedia.org
- Helmestine, Anne Marie, PH.D -d. (16. syyskuuta 2019). Enderonic vs Exergoninen reaktio ja prosessi. Toipunut: Admingco.com
- Exergoninen reaktio: Määritelmä ja esimerkki. (18. syyskuuta 2015). Toipunut: Opiskelu.com
- Khan -akatemia. (2018). Ilmaista energiaa. Palautettu: on.Khanacademy.org
- « Mekaaniset energiakaavat, konsepti, tyypit, esimerkit, harjoitukset
- Kestävä kulutus siihen, mikä on käyttö, merkitys, toimet, esimerkit »

