Kemialliset reaktioiden ominaisuudet, osat, tyypit, esimerkit

- 2259
- 407
- Sheldon Kuhn
Se kemialliset reaktiot Ne ovat muutoksia, jotka kärsivät atomiensa tilaamisesta, ja ne tapahtuvat, kun kaksi eri ainetta tai yhdistettä joutuvat kosketukseen. Prosessissa muutokset, jotka voidaan havaita välittömästi; kuten lämpötilan nousu, jäähdytys, kaasun muodostuminen, välähdykset tai kiinteän verran saostuminen.
Yleisimmät kemialliset reaktiot jäävät usein huomaamatta jokapäiväisessä elämässä; Tuhansia niistä suoritetaan kehomme. Toiset ovat kuitenkin näkyviä, koska voimme suorittaa ne keittiössä valitsemalla oikeat astiat ja ainesosat; Sekoita esimerkiksi bikarbonaatti etikan kanssa, sulatusokeri vedessä tai happamaa Coloradin mehu.
 Bikarbonaatin ja etikan reaktio on esimerkki toistuvasta kemiallisesta reaktiosta keittiössä. Lähde: Kate ter Har (https: // www.Flickr.com/valokuvat/Katerha/5703151566)
Bikarbonaatin ja etikan reaktio on esimerkki toistuvasta kemiallisesta reaktiosta keittiössä. Lähde: Kate ter Har (https: // www.Flickr.com/valokuvat/Katerha/5703151566) Laboratorioissa kemialliset reaktiot muuttuvat tavanomaisemmiksi ja yleisemmiksi; Kaikki esiintyy dekantterilasi (dekantterilasi) tai Erlenmeyer -pullot. Jos niillä on yhteistä, mikään ei ole yksinkertainen, koska ne piilottavat törmäykset, linkkitaukot, mekanismit, linkkien muodostumisen, energian ja kineettiset näkökohdat.
On niin silmiinpistäviä kemiallisia reaktioita, että fanit ja tutkijat, tietäen reagenssien ja joidenkin turvatoimenpiteiden toksikologian, toistavat ne suurilla asteikoilla kiehtovissa demonstraatioissa.
[TOC]
Kemiallinen reaktiokonsepti
Kemialliset reaktiot tapahtuvat, kun linkin rikkoutuminen (ioninen tai kovalenttinen) tapahtuu, niin että toinen muodostuu paikoilleen; Kaksi atomia tai joukko heistä lopettaa vuorovaikutuksen voimakkaasti uusien molekyylien aiheuttamiseksi. Tämän ansiosta yhdisteen kemialliset ominaisuudet, sen reaktiivisuus, stabiilisuus, mitä se reagoi voidaan määrittää.
Sen lisäksi, että asia on vastuussa kemiallisista reaktioista, jotka asia muuttuu jatkuvasti ilman atomejaan, he selittävät yhdisteiden syntymisen, kuten tunnemme ne.
Jotta linkit rikkoutuvat, energiaa vaaditaan, ja kun linkit muodostuvat, se vapautetaan. Jos absorboitunut energia on suurempi kuin vapautettu, sanotaan, että reaktio on endoterminen; Meillä on ympäröivä jäähdytys. Vaikka vapautuva lämpö on absorboiva parempi, se on eksoterminen reaktio; Ympäristö lämmitetään.
Kemiallisten reaktioiden ominaisuudet
Kinetiikka
Teorian molekyylien on tehtävä yhteistyö. Jos törmäykset ovat hitaita tai tehottomia, kemiallinen reaktio vaikuttaa kineettisesti. Tätä voi tapahtua joko aineiden fysikaalisten tilojen tai saman geometrian tai rakenteen avulla.
Siten reaktiossa asia muuttuu absorboimalla tai vapauttamalla lämpöä, samalla kun kärsivät törmäyksiä, jotka suosivat tuotteiden muodostumista; Minkä tahansa kemiallisen reaktion tärkeimmät komponentit.
Massan säilyttäminen
Massansuojelulain vuoksi sarjan kokonaismassa pysyy vakiona kemiallisen reaktion jälkeen. Siten kunkin aineen yksittäisten massojen summa on yhtä suuri kuin saadun tuloksen massa.
Fyysiset muutokset ja/tai valtion muutokset
Kemiallisen reaktion esiintymiseen voi liittyä komponenttien tilan muutos; toisin sanoen materiaalin kiinteän, nestemäisen tai kaasumaisen tilan muunnelma.
Kaikki tilan muutokset eivät kuitenkaan tarkoita kemiallista reaktiota. Esimerkiksi: Jos vesi haihtuu lämmön takia, tämän tilan muutoksen jälkeen tuotettu vesihöyry pysyy vedessä.
Värivaihtelu
Kemiallisesta reaktiosta johtuvien fysikaalisten ominaisuuksien joukossa reagenssien värin muutos lopputuotteen väriä erottuu.
Tämä ilmiö on huomattava, kun havaitaan metallien kemiallista reaktiota happea: Kun metalli hapettuu, se muuttaa ominaisväriään (kulta tai hopea, tapauksen mukaan), tullakseen appelsiiniruokaiseksi sävyksi, joka tunnetaan nimellä Rust.
Kaasun vapauttaminen
Tämä ominaisuus ilmenee kuplina tai tiettyjen hajujen päästöinä.
Yleensä kuplat näkyvät nesteen alistumisen seurauksena korkeissa lämpötiloissa, mikä rohkaisee reaktiota kuuluvien molekyylien kineettisen energian kasvua.
Lämpötilan muutokset
Jos lämpö on kemiallisen reaktion katalyytti, lopputuotteessa indusoidaan lämpötilan muutos. Siksi lämmön pääsy ja poistuminen prosessissa voivat myös olla ominaisuus kemiallisille reaktioille.
Kemiallisen reaktion osat
Reagenssit ja tuotteet
Mikä tahansa kemiallinen reaktio edustaa tyypin yhtälö:
A + B → C + D
Missä a ja b ovat reagensseja, kun taas C ja D tuotteet. Yhtälö kertoo meille, että atomi tai molekyyli A reagoi B: n kanssa aiheuttamaan tuotteita C ja D. Tämä on peruuttamaton reaktio, koska reagenssit eivät voi olla peräisin tuotteista. Sen sijaan alla oleva reaktio on palautuvaa:
A + B C + D
On tärkeää korostaa, että reagenssien massa (A+B) on oltava yhtä suuri kuin tuotteiden massa (C+D). Muuten taikinaa ei säilytetä. Samoin tietyn elementin atomien lukumäärän on oltava sama ennen nuolta ja sen jälkeen.
Nuolen yläpuolella osoittaa joitain reaktion eritelmiä: lämpötila (Δ), ultraviolettisäteilyn esiintyvyys (HV) tai käytetty katalysaattori.
Voi palvella sinua: kellalasiReaktio tarkoittaa
Elämän ja kehomme esiintyvien reaktioiden suhteen reaktion väliaine on vesipitoinen (AC). Kemiallisia reaktioita voidaan kuitenkin kehittää missä tahansa nestemäisessä väliaineessa (etanoli, jääetikkahappo, tolueeni, tetrahydrofuraani jne.) niin kauan kuin reagenssit ovat hyvin liuenneet.
Astiat tai reaktorit
Kontrolloituja kemiallisia reaktioita esiintyy säiliössä, olipa se yksinkertainen lasimateriaali tai ruostumattomasta teräksestä valmistetussa reaktorissa.
Kemiallisten reaktioiden tyypit
Kemiallisten reaktioiden tyypit perustuvat siihen, mitä tapahtuu molekyylitasolla; Mitkä linkit rikkovat ja kuinka atomit lopulta liittyvät. Otetaan myös huomioon, voivatko lajit vai menettävätkö elektronit; Jopa silloin, kun tämä tapahtuu useimmissa kemiallisissa reaktioissa.
Tässä on erityyppisiä kemiallisia reaktioita.
- Hapetuksen vähentäminen (Rédox)
Kuparin hapettuminen
Patinan esimerkissä tapahtuu hapettumisreaktio: Metallinen kupari menettää elektroneja hapen läsnä ollessa muuttumaan vastaavaksi oksidiksi.
4CU (S) + O2(g) => cu2Sinä)
Kuparioksidi (i) hapettuu edelleen kuparioksidin (II) saamiseksi:
2CU2Tai (s) + tai2 => 4Cuo (S)
Tämän tyyppinen kemiallinen reaktio, jossa lajit lisäävät tai vähentävät niiden hapettumismäärää (tai tila), tunnetaan hapettumis- ja pelkistysreaktiona (Rédox).
Metallinen kupari, jossa on hapettumistila 0, menettää ensin elektronin ja sitten toisen (hapettuu), kun taas happi pysyy (se vähenee):
Cu => cu+ + ja-
Cu+ => Cu2+ + ja-
JOMPIKUMPI2 + 2e- => 2nd2-
Elektronien lisäys tai menetys voidaan määrittää laskemalla hapettumismäärät atomien suhteen niiden tuloksena olevien yhdisteiden kemiallisissa kaavoissa.
Cu2Tai tiedetään, että koska se on oksidi, siinä on anionia tai2-, Joten neutraloitujen kuormitusten säilyttämiseen molemmissa kupariatomeissa on oltava +1. Hyvin samanlaista tapahtuu CuO: n kanssa.
Kupari, kun hapettuu, saa positiivisia hapettumislukuja; ja happea, vähentävä, negatiiviset hapettumismäärät.
Rauta- ja koboltti
Lisäesimerkkejä reaktioista on esitetty alla. Samoin tehdään lyhyt kommentti ja muutokset hapetuslukuissa määritetään.
FECL2 + Cocl3 => FECL3 + Cocl2
Jos hapettumisluvut lasketaan, huomataan, että CL: n lukumäärät pysyvät vakioarvolla -1; Ei niin, uskon ja yhteistyökumppanien kanssa.
Ensi silmäyksellä rauta on hapettunut, kun taas koboltti on vähentynyt. Kuinka tietää? Koska rauta on vuorovaikutuksessa nyt kahden Cl: n kanssa- Mutta kolmella, koska ne ovat elektronegatiivisin klooriatomi kuin rauta ja koboltti. Toisaalta, päinvastoin tapahtuu koboltille: se menee vuorovaikutuksesta kolmen CL: n kanssa- kahdelle heistä.
Jos aikaisempi päättely ei ole selvä, elektronien nettosiirron kemialliset yhtälöt kirjoitetaan:
Usko2+ => Usko3+ + ja-
Yhteistyö3+ + ja- => Co2+
Siksi usko2+ Se hapettaa, kun taas CO3+ on vähennetty.
Jodi ja mangaani
6 kmno4 + 5KI + 18HCL => 6MNCL2 + 5Kio3 + 6KCl+ 9H2JOMPIKUMPI
Yllä olevan kemikaali voi vaikuttaa monimutkaiselta, mutta se ei ole. Kloori (Cl-) ei happea (tai2-) kokemus heidän elektroniensa voitosta tai menetyksestä. Jodi ja mangaani, kyllä.
Ottaen huomioon vain yhdisteet jodilla ja mangaanilla, sinulla on:
Ki => Kio3 (Hapetusnumero: -1 -+5, menettää kuusi elektronia)
Kmno4 => Mcl2 (Hapetusnumero: +7 - +2, voittaa viisi elektronia)
Jodi hapettaa, kun mangaani vähenee. Kuinka tietää laskematta? Koska jodi siirtyy kaliumin kanssa olla vuorovaikutuksessa kolmen hapen kanssa (enemmän elektronegatiivista); Ja mangaani, sillä välin menettää vuorovaikutukset hapen kanssa kloorin kanssa (vähemmän elektronegatiivista).
KI ei voi menettää kuutta elektronia, jos KMNO4 Voittaa viisi; Siksi elektronien lukumäärän on oltava tasapainossa yhtälössä:
5 (Ki => KIO3 + 6e--A
6 (kmno4 + 5e- => Mcl2-A
Joka aiheuttaa 30 elektronin nettosiirtoa.
Palaminen
Poltto on voimakas ja energinen hapetus, jossa valo ja lämpö vapautuvat. Yleensä tämän tyyppisessä kemiallisessa reaktiossa happea osallistuu hapettavana tai yhdistävänä aineena; Vaikka pelkistävä aine on polttoaine, joka palaa tilin lopussa.
Missä on tuhkaa, palamista oli. Nämä koostuvat hiili- ja metallioksideista; vaikka sen koostumus riippuu loogisesti siitä, mikä polttoaine oli. Alla on joitain esimerkkejä:
C (s) + o2(g) => co2(g)
2CO (g) + tai2(g) => 2co2(g)
C3H8(g) + 5o2(g) => 3co2(g) + 4H2O (g)
Jokainen näistä yhtälöistä vastaa täydellisiä paloja; toisin sanoen kaikki polttoaine reagoi ylimääräisen hapen kanssa sen täydellisen muutoksen takaamiseksi.
On myös huomattava, että CO2 ja h2Tai ne ovat kaasumaisia enemmistötuotteita, kun hiilihapotetut kappaleet palaavat (kuten puu, hiilivedyt ja eläinkudokset). On väistämätöntä, että jonkin verran hiilen alotrooppista muodostetaan happea vajaatoiminnan vuoksi, samoin kuin vähemmän hapettuneita kaasuja, kuten CO eikä ei.
- Synteesi
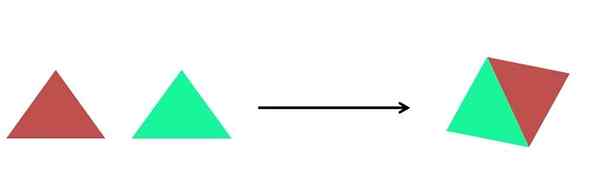
 Synteesireaktion graafinen esitys. Lähde: Gabriel Bolívar.
Synteesireaktion graafinen esitys. Lähde: Gabriel Bolívar. Ylivoimaisessa kuvassa esitetään hyvin yksinkertainen esitys. Jokainen kolmio on yhdiste tai atomi, jotka tulevat yhteen muodostaen yhden yhdisteen; Kaksi kolmiota muodostavat rinnakkaisgrammin. Massat lisääntyvät ja tuotteen fysikaaliset ja kemialliset ominaisuudet ovat usein hyvin erilaisia kuin niiden reagenssit.
Voi palvella sinua: entalpiaEsimerkiksi vety (joka on myös rédox -reaktio) palaminen tuottaa vetyoksidia tai happea hydridiä; tunnetaan paremmin nimellä Agua:
H2(g) + tai2(g) => 2h2O (g)
Sekoittamalla molemmat kaasut, korkeassa lämpötilassa, poltto tuottaa kaasumaista vettä. Jäähdytetyt lämpötilat, höyryt tiivistyvät nestemäisen veden antamiseksi. Useat kirjoittajat pitävät tätä synteesireaktiota yhtenä mahdollisista vaihtoehdoista fossiilisten polttoaineiden korvaamiseksi energian saamiseksi.
H-H ja O = O-linkit on rikki muodostamaan kaksi uutta yksinkertaista linkkiä: H-O-H. Vesi, kuten hyvin tiedetään, on vertaansa vailla oleva aine (romanttisen merkityksen ulkopuolella), ja sen ominaisuudet eroavat melko paljon kaasumaisesta vedystä ja happea.
Ioniyhdisteet
Ionisten yhdisteiden muodostuminen sen elementeistä on myös esimerkki synteesireaktiosta. Yksi yksinkertaisimmista on ryhmien 1 ja 2 metallien halvojen muodostuminen. Esimerkiksi kalsiumbromidin synteesi:
Ca (s) + br2(L) => CABR2(S)
Yleinen yhtälö tämän tyyppiselle synteesille on:
M (s) + x2 => Mx2(S)
Koordinaatio
Kun muodostettu yhdiste sisältää metallisen atomin elektronisessa geometriassa, sanotaan, että se on kompleksi. Komplekseissa metallit pysyvät yhdistyneinä ligandin kanssa heikojen kovalenttisten sidosten avulla, ja ne muodostuvat koordinaatioreaktioilla.
Esimerkiksi sinulla on kompleksi [CR (NH3-A6-3+. Tämä muodostuu, kun se on3+ on ammoniakkimolekyylien läsnäollessa, NH3, jotka toimivat kromiligandina:
Cr3+ + 6nh3 => [Cr (NH3-A6-3+
Alla on tuloksena oleva koordinaatio oktaedroni kromimetallikeskuksen ympärillä:
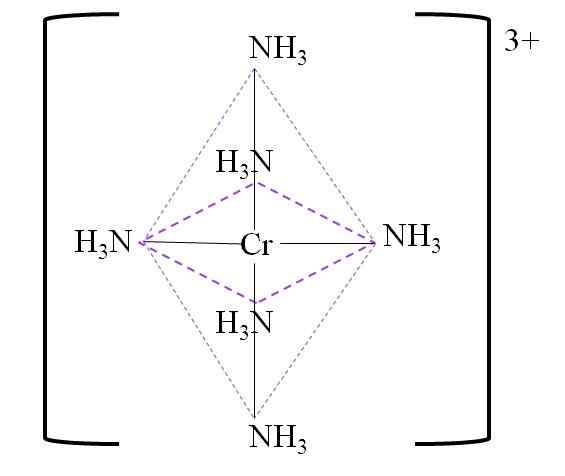 Koordinointi oktaedroni kompleksille. Lähde: Gabriel Bolívar.
Koordinointi oktaedroni kompleksille. Lähde: Gabriel Bolívar. Huomaa, että kromi 3+ -kuormaa ei neutraloida kompleksissa. Sen väri on violetti, ja siksi oktaedroni on edustettuna mainitulla värillä.
Jotkut kompleksit ovat mielenkiintoisempia, kuten tiettyjen entsyymien tapauksessa, jotka koordinoivat rautaa, sinkkiä ja kalsiumiatomeja.
- Hajoaminen
Hajoamisesta tulee synteesin vastakohta: yhdiste hajoaa yhdeksi, kahteen tai kolmeen elementtiin tai yhdisteeseen.
Esimerkiksi seuraavat kolme hajoamista:
2HGO (S) => 2HG (L) + O2(g)
2H2JOMPIKUMPI2(L) => 2h2Tai (l) + o2(g)
H2Yhteistyö3(AC) => CO2(g) + h2Tai (l)
HGO on punertavan kiinteä aine, joka lämmönvaikutuksella murtuu metallisiksi elohopeaksi, mustaksi nesteeksi ja happeksi.
Vetyvetyperoksidi kärsii hajoamisesta, mikä antaa nestemäistä vettä ja happea.
Ja hiilihappo, joka puolestaan hajoaa hiilidioksidissa ja nestemäisessä vedessä.
"Kuiva" hajoaminen on metallikarbonaattien kärsimä:
Varas3(s) => cao (s) + co2(g)
Luokan tulivuori
 Huonekalut Ammonium dikromaatti tulivuori. Lähde: наталия [cc by-Sa 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]
Huonekalut Ammonium dikromaatti tulivuori. Lähde: наталия [cc by-Sa 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Kemian luokissa käytetty hajoamisreaktio on ammoniumdikromaatin lämpöhajoaminen (NH4-A2Cr2JOMPIKUMPI7. Tämä appelsiinihiirenogeenisuola (joten sitä tulisi käsitellä erittäin huolellisesti), palovammat vapauttaakseen paljon lämpöä ja tuottamaan vihreän kiinteän, kromioksidin, CR: n2JOMPIKUMPI3-
(NH4-A2Cr2JOMPIKUMPI7(s) => cr2JOMPIKUMPI3(S) + 4H2Tai (g) + n2(g)
- Siirtymä
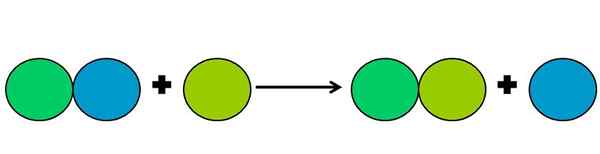 Siirtymäreaktion graafinen esitys. Lähde: Gabriel Bolívar.
Siirtymäreaktion graafinen esitys. Lähde: Gabriel Bolívar. Siirtymäreaktiot ovat eräänlainen reaktio -rédox, jossa yksi elementti syrjäyttää toisen yhdisteessä. Siirtyneet elementti lopulta vähentämään tai saamaan elektroneja.
Yllä olevan yksinkertaisen yksinkertaistamiseksi ylempi kuva on esitetty. Ympyrät edustavat elementtiä. Havaitaan, että Liman vihreä ympyrä syrjäyttää sinisen ollessa ulkopuolella; Mutta ei vain, mutta sininen ympyrä vähenee prosessissa, ja vihreän liman prosessi on hapettunut.
Vety
Esimerkiksi seuraavat kemialliset yhtälöt, jotka paljastavat yllä:
2Al (s) + 6HCl (AC) => Alcl3(AC) + 3H2(g)
Zr (s) + 2h2Tai (g) => zro2(s) + 2h2(g)
Zn (s) + h2Sw4(AC) => Znso4(AC) + H2(g)
Mikä on siirtynyt elementti näille kolmelle kemialliselle reaktiolle? Vety, joka pelkistetään molekyyliseen vetyyn, H2; siirtyy +1: n hapettumisnumerosta 0. Huomaa, että alumiini-, zirkonium- ja sinkkimetallit voivat syrjäyttää happojen ja veden hydrogeenit; Vaikka kupari, hopea tai kulta, ei voi.
Metallit ja halogeeni
Samoin nämä kaksi ylimääräistä siirtymäreaktiota on saatavana:
Zn (s) + cuo4(ac) => cu (s) + znso4(AC)
Cl2(g) + 2nai (ac) => 2nacl (ac) + i2(S)
Ensimmäisessä reaktiossa sinkki syrjäyttää vähemmän aktiivisen metallin kuparin; Sinkki hapettuu, kun kupari vähenee.
Toisessa reaktiossa, toisaalta kloori, reaktiivisempi elementti kuin jodi, syrjäyttää jälkimmäisen natriumsuolaan. Tässä tapahtuu taaksepäin: Reaktiivisin elementti vähenee hapettamalla siirtynyt elementti; Siksi kloori vähenee hapettumista jodiksi.
- Kaasunmuodostus
Reaktioissa voitiin nähdä, että useat niistä tuottivat kaasuja, ja siksi ne tulevat myös tämän tyyppiseen kemialliseen reaktioon. Samoin edellisen osan reaktioita, vedyn siirtymistä aktiivisella metallilla, pidetään kaasunmuodostusreaktioina.
Voi palvella sinua: Dodecil -natriumsulfaatti (SDS): rakenne, ominaisuudet, käyttötarkoituksetJo mainittujen lisäksi esimerkiksi metallisulfidit vapauttavat rikkivety (joka haisee mätä munia), kun suolahappoa lisätään:
Naa2S (s) + 2HCl (AC) => 2NACL (AC) + H2S (g)
- Metaheesis tai kaksinkertainen siirtymä
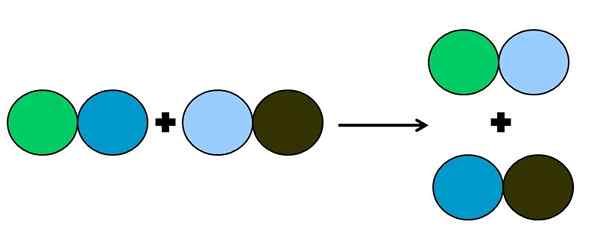 Kaksinkertaisen siirtymäreaktion graafinen esitys. Lähde: Gabriel Bolívar.
Kaksinkertaisen siirtymäreaktion graafinen esitys. Lähde: Gabriel Bolívar. Metateesin tai kaksinkertaisen siirtymän reaktiossa tapahtuu parien muutos ilman elektroninsiirtoja; eli sitä ei pidetä reaktiona rédox. Kuten ylemmässä kuvassa voidaan nähdä, vihreä ympyrä katkaisee linkin tummansinisen kuvan linkittämiseksi vaaleansiniseen ympyrään.
Sademäärä
Kun yhden parin vuorovaikutukset ovat riittävän vahvoja nesteiden ratkaisemisen vaikutuksen voittamiseksi, saadaan sakka. Seuraavat kemialliset yhtälöt edustavat saostumisreaktioita:
Agno3(ac) + nacl (ac) => agcl (s) + nano3(AC)
Kacl2(AC) + NA2Yhteistyö3(ac) => caco3(s) + 2nacl (AC)
Ensimmäisessä reaktiossa Cl- syrjäyttää ei3- Hopeakloridin muodostamiseksi, AGCL, joka on valkoinen sakka. Ja toisessa reaktiossa CO32- syrjäyttää Cl: n- Kalsiumkarbonaatin saostamiseksi.
Emäshappo
Ehkä kaikkein symbolismin metathaneesireaktioista on neutralointipohjahappo. Lopuksi, kaksi emäshapporeaktiota esitetään esimerkinä:
HCl (AC) + NaOH (AC) => NaCl (AC) + H2Tai (l)
2HCl (AC) + BA (OH)2(AC) => BACL2(AC) + 2H2Tai (l)
VAI NIIN- He siirtyvät CL: ään- Veden ja kloridisuolojen muodostamiseksi.
Esimerkkejä kemiallisista reaktioista
Alla ja sitten mainitaan joitain kemiallisia reaktioita niiden vastaavien yhtälöiden ja kommenttien kanssa.
Siirtymä
Zn (s) + Agno3(AC) → 2Ag (s) + Zn (ei3-A2(AC)
Sinkki syrjäyttää hopean nitraattisuolaansa: se vähentää AG: tä+ AG. Seurauksena on, että metallihopea alkaa saostaa keskellä, havaitaan mikroskoopilla, joka hopeavapaa puita. Toisaalta nitraatti yhdistetään Zn -ioneihin2+ Tuloksena muodostaa sinkkinitraatin.
Neutralointi
Varas3(S) + 2HCL (AC) → CACL2(AC) + H2Tai (l) + Co2(g)
Kloorivetyhappo neutraloi kalsiumkarbonaattisuolaa suolan, kalsiumkloridin, veden ja hiilidioksidin tuottamiseksi. Yhteistyökumppani2 kuplia ja havaitaan vedessä. Tämä kupla3.
Nh3(g) + hcl (g) → nh4Cl (s)
Tässä toisessa reaktiossa HCl -höyryt neutraloivat kaasumaisen ammoniakin. Suolan ammoniumkloridi, NH4Cl, muodostuu kuin valkeahko (alempi kuva), koska se sisältää erittäin hienoja hiukkasia suspendoituneita ilmaan.
 Ammoniumkloridiharjoittelu reaktio. Lähde: Adam Rędzikowski [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]
Ammoniumkloridiharjoittelu reaktio. Lähde: Adam Rędzikowski [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Kaksoissiirto
Agno3(AC) + NaCl (AC) → Agcl (s) + nano3(AC)
Kaksinkertaisessa siirtymäreaktiossa "parit" vaihdetaan. Hopea muuttaa pari natriumia. Tuloksena on, että uusi suola, hopeakloridi, agcl, saostuu kuin maitomaista.
Rédox
 Kemiallisessa reaktiossa haukkua koiran lämpö, ääni ja sininen valo vapautuu. Lähde: Maxim Bilovitskiy Wikipedian kautta.
Kemiallisessa reaktiossa haukkua koiran lämpö, ääni ja sininen valo vapautuu. Lähde: Maxim Bilovitskiy Wikipedian kautta. Rédox on lukemattomia reaktioita. Yksi vaikuttavimmista on Barkin Dog:
8 n2Tai (g) + 4 cs2(L) → S8(s) + 4 Co2(g) + 8 n2(g)
Vapautuva energia on niin paljon, kun kolme stabiilia tuotetta muodostetaan, että sinertävä salama (ylivoimainen kuva) ja kaasujen aiheuttaman paineen nouseva nousu (Co CO (CO2 ja n2-A.
Ja lisäksi kaikki tämä liittyy erittäin vahva ääni, joka on samanlainen kuin koiran haukkuminen. Tuotettu rikki, S8, Peitä putken sisäseinät keltainen.
Mikä laji vähenee ja mikä hapettuu? Yleensä elementeillä on hapettumisnumero 0. Siksi tuotteiden rikin ja typen on oltava lajeja, jotka ovat saaneet tai menettäneet elektronit.
Rikki hapettunut (kadonneet elektronit), koska sen hapettumisnumero -2 oli CS: ssä2 (C4+S22-)
S2- → S0 - + 2e-
Vaikka typpe väheni (voitti elektronit), koska sen hapettumismäärä +1 oli N: ssä2Tai (n2+JOMPIKUMPI2-)
2N+ + 2e → n0 -
Ratkaistu kemialliset reaktiot
- Harjoitus 1
Mikä suola saostuu seuraavassa reaktiossa vesipitoisessa väliaineessa?
Naa2S (ac) + feso4(AC) →?
Yleensä kaikki sulfidit, lukuun ottamatta alkali- ja ammoniummetallien muodostuneita, saostuvat vesipitoisessa väliaineessa. Kaksinkertainen siirtymä tapahtuu: rauta sitoutuu sulfidiin ja natriumin kanssa sulfaatin kanssa:
Naa2S (ac) + feso4(ac) → fes (s) + na2Sw4(AC)
- Harjoitus 2
Mitä tuotteita saamme seuraavasta reaktiosta?
Leima3-A2 + CA (OH)2 →?
Kalsiumhydroksidi ei ole kovin liukoinen veteen; Mutta kuparinitraatin lisääminen auttaa liuottamaan sitä, koska se reagoi muodostaen vastaavan hydroksidin:
Leima3-A2(AC) + CA (OH)2(AC) → Cu (OH)2(S) + CA (ei3-A2(AC)
Cu (OH)2 Se tunnustetaan heti sinisen sateen olevan.
- Harjoitus 3
Mitä suolaa tapahtuu seuraavassa neutralointireaktiossa?
Al (OH)3(S) + 3HCL (AC) → ¿¿?
Alumiinihydroksidi käyttäytyy emäkseksi, joka reagoi suolahappon kanssa. Happo-emäs neutraloinnin reaktiossa (brnsted-matala) vettä muodostuu aina, joten toisen tuotteen on oltava alumiinikloridia, ALCL3-
Al (OH)3(S) + 3HCL (AC) → ALLL3(AC) + 3H2JOMPIKUMPI
Tällä kertaa Alcl3 Se ei saosta, koska se on suola (jossain määrin) liukeneva veteen.
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Ana zita. (18. marraskuuta 2019). Kemialliset reaktiot. Toipunut: Todamateria.com
- Kashyap Vyas. (23. tammikuuta 2018). 19 viileää kemiallista reaktiota, jotka Prov Science on haalistunut. Toipunut: mielenkiintoinen.com
- Kauniskemia.s.F.-A. Reaktio. Toipunut: BeautifulChemistry.netto
- Wikipedia. (2019). Kemiallinen reaktio. Haettu: vuonna.Wikipedia.org

