Takeran ominaisuudet, rakenne, toiminnot
- 3842
- 1051
- Louis Moen
Se Sakera, Se tunnetaan myös nimellä Tabera-isomaltaasikompleksi, se on kalvoentsymaattinen kompleksi, jolla.
Sitä on läsnä monien maaeläinten, kuten nisäkkäiden, lintujen ja matelijoiden, suoliston mikroviivoissa. Eri bibliografisten lähteiden mukaan muut tämän entsyymin hyväksytyt nimet ovat oligo-1,6-glukosidaasi, a-metyyliglukosidaasi, isomaltaasi ja oligosakkaridi a-1,6-glukosidaasi.
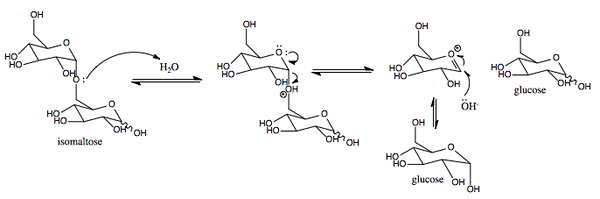
 Graafinen esitys SACA: n vaikutusmekanismista.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta)
Graafinen esitys SACA: n vaikutusmekanismista.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta) Se on entsyymi, jonka aktiivisuus on samanlainen kuin käänte. Sen ensisijainen tehtävä on hydrolysoi.
Sillä on erittäin tärkeitä ruuansulatusfunktioita, koska sakkaroosia ei voida kuljettaa disakkaridina suolistosoluihin, ja siksi sen hydrolyysi mahdollistaa sen ainesosan monosakkaridien suoliston imeytymisen.
Suunnittelija-isomaltaasin synteesiä ja aktiivisuutta eläinten suolistosoluissa säädetään monilla tasoilla: transkription ja translaation aikana, glykosylaation aikana ja myös sen translaation jälkeisen prosessoinnin aikana.
Kun jokin näistä tapahtumista epäonnistuu tai jonkin tyyppinen mutaatio tapahtuu sitä koodaavassa geenissä, ihmisillä on patologinen tila, joka tunnetaan nimellä sakkaroosin puutteen oireyhtymä, joka liittyy disakkaridien metaboloinnin mahdottomuuteen.
[TOC]
Ominaisuudet
Nisäkkäiden nisäkkäiden substraattina toimivat disakkaridit ovat yleensä syljen ja haiman a-amylaasien entsyymien hydrolyyttisen aktiivisuuden tuote. Tämä johtuu tosiasiasta, että sacas ei vain hydrolysoi sakkaroosin glukosidisia sidoksia, vaan myös maltoosin ja maltotrosan a-1,4-sidoksia ja muita oligosakkarideja.
Saman puoli -elämä vaihtelee välillä 4–16 tuntia, joten suolen solut sijoittavat paljon.
Voi palvella sinua: mikä on Crenation? (Biologia)Synteesi
Kuten useimmat kattavimmat hydrolaasientsyymit, myös sakkarat (kovinja-isomaltaasi tai kyllä) ovat syntetisoitu glykoproteiini harjan reunasoluissa, kuten polypeptidi-esiaste, merkitty pro-if.
Tämä edeltäjän molekyyli kuljetetaan solujen apikaaliseen pintaan, ja haiman proteaasit jalostetaan entsymaattisesti, jotka jakavat sen kahteen eri alayksikköön: isomaltaasin alayksikkö ja Subunidad Subunidad.
Isomaltaasin alayksikkö vastaa Pro-Si: n pääte aminopäätä ja siinä on hydrofobinen segmentti (hydrofobinen ankkuri) N-terminaalisessa päässä. Tämän avulla voit liittyä suolistosolujen plasmamembraaniin harjan reunalla.
Tätä ihmisillä olevaa kompleksia koodaava geeni sijaitsee kromosomin 3 pitkässä käsivarressa ja ottaen huomioon molempien alayksiköiden (yli 40%) välisen sekvenssin suuren homologian (yli 40%) on ehdotettu, että tämä entsyymi syntyi geneettisen kopiointitapahtuman kautta.
On todistettu, että sekä alayksiköt, isomaltaasi ja sacas kykenevät hydrolyziin.
Rakenne
Entsyymi-SACA: n, pro-si-polypeptidin, alkuperäisessä muodossa on noin 260 kDa ja 1827 aminohappoja. Haiman proteaasien proteolyyttinen aktiivisuus tuottaa kuitenkin kaksi 140 kDa: n alayksikköä ja 120 kDa, jotka edustavat vastaavasti isomaltaattia ja sacarasia.
Tämä entsyymi on glykoproteiini, jolla on sakkaridi -osa N- ja JOMPIKUMPI-Glykosiladas ja niiden sekvenssin tutkimukset paljastavat yli 19 glykosylaatiokohdan läsnäolon. Hiilihydraattiosat edustavat yli 15% proteiinin painosta ja koostuvat olennaisesti sisalapihaposta, galaktosamiinista, kädestä ja N-asetyyliglukosamiinista.
Voi palvella sinua: Leusiini: Ominaisuudet, rakenne, toiminnot, biosynteesiKoska sacrase-isomalttikompleksin kaksi alayksikköä eivät ole täsmälleen samat, monet kirjoittajat katsovat, että tämä entsyymi on todellisuudessa heterodimeeri, jossa kukin alayksikkö koostuu glykosyloidusta lineaarisesta polypeptidiketjusta ja että se liittyy ei-kovalenttisiin linkkien kautta.
Isomaltaasin alayksikössä on hydrofobinen segmentti 20 aminohappojätteestä, joka on mukana sen yhteydessä enterosyyttien (suolisolujen) kalvon kanssa ja jotka edustavat pysyvää ankkuria ja peptidisignaalia menemään endoplasmiseen retikulumiin,.
Molempien alayksiköiden, SACA: n ja isomaltaasin, aktiivista paikkaa löytyy enterosyyttien plasmamembraanista, ulkonevan suoliston luumeniin.
Funktiot
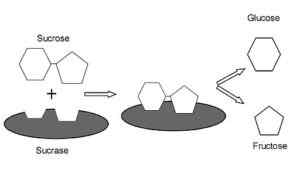
Entsyymien, kuten tarkastaja-isomaltaasin, tärkeimmät metaboliset toiminnot liittyvät glukoosin ja fruktoosin tuotantoon sakkaroosista. Monosakkaridit, jotka kuljetetaan suolistosoluihin ja jotka on sisällytetty erilaisiin aineenvaihduntareitteihin eri tarkoituksiin.
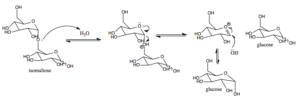 Sokeri-isomaltaasin vaikutusmekanismi nisäkkäissä (lähde: AREID3 [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta)
Sokeri-isomaltaasin vaikutusmekanismi nisäkkäissä (lähde: AREID3 [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta) Glukoosi, jolle on olemassa spesifisiä kuljettajia, voidaan suunnata solunsisäisesti glykolyysiin, jossa sen hapettuminen johtaa energian tuotantoon ATP: n muodossa ja vähentää voimaa NADH: n muodossa.
Fruktoosi puolestaan voidaan metaboloida myös reaktiosarjalla, jotka alkavat sen fosforylaatiolla fruktoosiksi 1-fosfaatiksi ja katalysoimalla maksan fruktokinaasilla. Tämä aloittaa tämän substraatin sisällyttämisen muihin energiantuotantoreitteihin.
Lisäksi, kuten kasveissa käännettynä entsyymissä, sokeri-isomaltaasiaktiivisuudella on tärkeitä vaikutuksia solujen näkökohtiin, kuten osmoottiseen paineeseen, jotka yleensä ottavat fysiologiset tapahtumat, kuten kasvu, kehitys, molekyylien kuljetus ja muut.
Ihmisiin liittyvät sairaudet
Ihmisillä on synnynnäinen autosomaalinen sairaus Synnynnäinen Lindy-isomaltaasin vajaatoiminta), joka liittyy oligo-ruuansulatuksen ja osmoottisesti aktiivisten disakkaridien virheisiin.
Voi palvella sinua: PerustamisvaikutusTämä tauti liittyy useisiin samanaikaisiin tekijöihin, joista entsyymin, geneettisten mutaatioiden, virheiden aikana kuljetuksen aikana jne.
Tätä tilaa on vaikea diagnosoida, se on usein sekoitettu laktoosi -intoleranssiin. Siksi se tunnetaan myös nimellä "sakkarosin intoleranssi".
Sille on ominaista vatsakramppien, ripulin, oksentelun, jaquecasin kehitys, johon liittyy hypoglykemia, kasvun puute ja painonnousu, ahdistus ja kaasujen liiallinen tuotanto.
Viitteet
- Brunner, J., Hauser, H., Braun, h., Wilson, k., Wecker, W., O'Neill, b., & Siemenza, G. (1979). Entsyymikompleksin lygaasi-isomaltaasin assosiaatiotapa suolen harjan reunuskalvolla. Biologisen kemian lehti, 254(6), 1821-1828.
- Cowell, G., Tranum-Jensen, J., Sjöström, h., & Norén tai. (1986). Pro-sukraasin / isomaltaasin ja lopullisen muotoisen simred / isomaltaasin topologia ja kvaternäärinen rakenne. Lehden biokemiallinen, 237, 455-461.
- Hauser, H., & Siemenza, G. (1983). Limade-isomaltaasi: Harjan reunuskalvon varjostettu luontainen proteiini. Kriittiset arvostelut Biochissa, 14(4), 319-345.
- Hunziker, W., Spiesss, m., Siemenneste, g., & Loodish, h. F. (1986). Limade-lsomaltaasikompleksi: primaarinen rakenne, kalvotietoisuus ja varustetun, luontaisen harjan reunaproteiinin evoluutio. Solu, 46, 227-234.
- Naim, h. JA., Roth, J., Sterchi, e. JA., Lentze, m., Mailin mailia., Schmitz, J., & Hauril, H. (1988). Lind-isomaltaasin vajaatoiminta ihmisillä. J -. Klinikka. Sijoittaa., 82, 667-679.
- Rodriguez, minä. R -., Taravel, f. R -., & Whelan, W. J -. (1984). Sian suolen Linde-isomaltaasin ja sen erillisten alayksiköiden karakterisointi ja toiminta. Euro. J -. Biokemia., 143, 575-582.
- Schiweck, H., Clarke, m., & Pollach, G. (2012). Sokeri. Sisään Ullmannin teollisuuskemian tietosanakirja (Vol. 34, p. 72). Wiley-VCH Verlag GmbH & Co. Kgaa.
- Treem, w. (tuhatyhdeksänsataayhdeksänkymmentäviisi). Synnynnäinen Lindy-isomaltaasin vajaatoiminta. Lehti lasten gastroenterologia ja ravitsemus, kaksikymmentäyksi, 1-14.

