Orgaaniset suolat
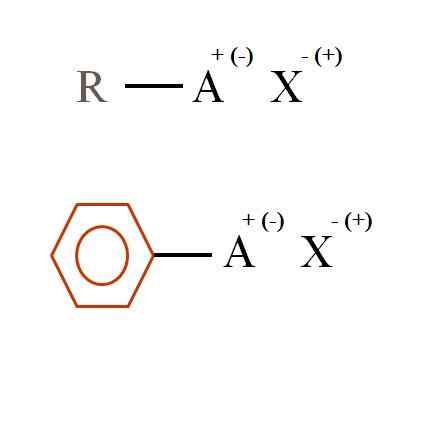
- 3914
- 65
- Sheldon Kuhn
 Kaksi yleistä kemiallista kaavaa orgaanisille suoloille. Lähde: Gabriel Bolívar
Kaksi yleistä kemiallista kaavaa orgaanisille suoloille. Lähde: Gabriel Bolívar Mitkä ovat orgaanisia suoloja?
Se Orgaaniset suolat Ne ovat tiheä määrä ionisia yhdisteitä, joilla on lukemattomia ominaisuuksia. Aiemmin johdettu orgaanisesta yhdisteestä, joka on tehnyt muutoksen, joka sallii sen olevan lastia ja että sen kemiallinen identiteetti riippuu niihin liittyvästä ionista.
Ylemmässä kuvassa kaksi hyvin yleistä kemiallista kaavaa esitetään orgaanisille suoloille. Ensimmäinen, R-Ax, tulkitaan yhdisteenä, jonka hiilirakenteessa atomi tai ryhmä A käyttää positiivista + tai negatiivista kuormaa (-).
Kuten voidaan nähdä, R: n ja A: n, R-A: n välillä on kovalenttinen sidos, mutta puolestaan sillä on muodollinen kuorma, joka houkuttelee (tai hylkää) ioniin X. Kuormitusmerkki riippuu A: n luonteesta ja kemiallisesta ympäristöstä.
Jos se oli positiivinen, kuinka monta x voisi olla vuorovaikutuksessa? Yhdellä, kun otetaan huomioon elektroneutraalisuuden periaate (+1-1 = 0). Mikä on X: n identiteetti? Anion X voi olla CO32-, vaatii kahta katiota RA: ta+; A Halogenidi: f-, Cl-, Br-, jne.; tai jopa toinen yhdiste-. Vaihtoehdot ovat lukimattomia.
Samoin orgaaninen suola voi olla aromaattinen, havainnollistettu bentseeninruskeassa renkaassa. Kuparibentsoaattisuola (II) (C6H5Kujertaa)2Esimerkiksi Cu koostuu kahdesta aromaattisesta renkaasta, joissa on negatiivisesti ladattuja karboksiryhmiä, jotka ovat vuorovaikutuksessa kationin kanssa2+.
Orgaanisten suolojen fysikaaliset ja kemialliset ominaisuudet
Kuvasta voidaan vahvistaa, että orgaaniset suolat koostuvat kolmesta komponentista: orgaanisesta, R- tai AR: stä (aromaattinen rengas), ionisen kuorman A atomi tai ryhmäkantaja ja vasta -x x.
Aivan kuten kemiallinen identiteetti ja rakenne määrittelevät tällaiset komponentit, samalla tavalla niiden ominaisuudet riippuvat niistä.
Tästä tosiasiasta tietyt yleiset kiinteistöt, jotka täyttävät suurimman osan näistä suoloista, voidaan tiivistää.
Voi palvella sinua: Hapetusnumero: Konsepti, miten se pääsee ulos ja esimerkkejäSuurimolekyylimassat
Olettaen,. Tämä johtuu pääasiassa hiilihapotetusta luurankosta, jonka yksinkertaiset C-C-sidokset ja sen vetyatomit tarjoavat yhdisteelle paljon massaa.
Siksi he ovat vastuussa korkeasta molekyylimassastaan.
Amfifialiset ja pinta -aktiiviset aineet
Orgaaniset suolat ovat amfifiilisiä yhdisteitä, toisin sanoen niiden rakenteilla on sekä hydrofiilisiä että hydrofobisia ääripäitä.
Mitkä ovat sellaiset äärimmäisyydet? R tai AR edustavat hydrofobista päätä, koska niiden atomilla C ja H ei ole suurta affiniteettia vesimolekyyleihin.
-Lla+(-), Atomi- tai lastin kantoryhmä on hydrofiilinen pää, koska se myötävaikuttaa dipolimomenttiin ja on vuorovaikutuksessa veden muodostavan dipolin kanssa (RA+ vai niin2-A.
Kun hydrofiiliset ja hydrofobiset alueet polarisoivat, amfifiilisestä suolasta tulee pinta -aktiivinen aine, aine, jota käytetään laajasti pesuaineiden ja pesuaineiden ja kokonaisvaltainen.
Korkeat kiehumispisteet tai fuusio
Kuten epäorgaaniset suolat, myös orgaaniset suolat ovat korkeat sulamis- ja kiehumispisteet, johtuen nestemäisessä tai kiinteässä faasissa olevat sähköstaattiset voimat.
Kuitenkin orgaanisen komponentin R tai AR, muun tyyppiset van der waalit (Lontoo, dipolo-dipolo, vety sillat) osallistuvat jollain tavalla sähköstaattisella tavalla.
Tästä syystä orgaanisten suolojen kiinteät tai nestemäiset rakenteet ovat ensisijaisesti monimutkaisempia ja monimuotoisempia. Jotkut heistä voivat jopa käyttäytyä kuten nestekiteitä.
Happamuus ja emäksisyys
Orgaaniset suolat ovat yleensä vahvempia hapoja tai emäksiä kuin epäorgaaniset suolat. Tämä johtuu siitä, että esimerkiksi amiinisuoloissa sillä on positiivinen kuorma johtuen sen yhteydestä ylimääräiseen vetyyn: a+-H. Lahjoita sitten kosketuksessa pohjan kanssa protoni uudelleen neutraaliksi yhdisteeksi:
Se voi palvella sinua: Strontium: historia, rakenne, ominaisuudet, reaktiot ja käyttötarkoituksetRata+H + B => ra + Hb
H kuuluu A: lle, mutta on kirjoitettu, koska se puuttuu neutralointireaktioon.
Toisaalta Ra+ Se voi olla suuri molekyyli, joka ei pysty muodostamaan kiinteitä aineita kiteisen verkon stabiililla hydroksyylianionilla tai oksydrilo -OH: lla-.
Kun näin on, suola -ram+vai niin- Se käyttäytyy kuin vahva pohja; Jopa niin emäksinen kuin NaOH tai KOH:
Rata+vai niin- + Hcl => racl + h2JOMPIKUMPI
Huomaa kemiallisessa yhtälössä, että anioni CL- Vaihda OH-, muodostaen suola Ra -+Cl-.
Orgaanisten suolojen käyttö
Orgaanisten suolojen käyttö vaihtelee R: n, A: n, A: n ja X: n identiteetin mukaan. Lisäksi sovellus, johon ne allokoidaan. Joitakin yleisiä tässä suhteessa ovat:
- Ne toimivat reagenssina muiden orgaanisten yhdisteiden synteesille. Rax voi toimia R -ketjun "antajana" lisätäkseen toiseen yhdisteeseen, joka korvaa hyvän lähtevän ryhmän.
- Ne ovat pinta -aktiivisia aineita, joten niitä voidaan käyttää myös voiteluaineina. Tätä tarkoitusta varten käytetään metallikarboksyyliaatesuoloja.
- Ne sallivat syntetisoida monenlaisia väriaineita.
Esimerkkejä orgaanisista suoloista
Karboksylaatit
Karboksyylihapot reagoivat hydroksidin kanssa neutralointireaktiossa, aiheuttaen karboksyyliaalaattisuoloja: RCOO- M+; missä m+ Se voi olla mikä tahansa metallinen kation (na+, Pb2+, K -k -+, jne.) tai ammoniumin kationi4+.
Rasvahapot ovat pitkäketjuisia karboksyylihappoja, ne voivat olla tyydyttyneitä ja tyydyttymättömiä. Palmitiinihappo ovat tyydyttyneitä (valitse3(CH2-A14Cooh). Tämä on peräisin palmitaattisuolasta, kun taas steariinihappo (CHO3(CH2-A16COOH muodostaa Stear -suolan. Saippuat muodostetaan näistä suoloista.
Voi palvella sinua: Yleinen kaasulakiBentsoehapon tapauksessa C6H5Cooh (missä c6H5- Se on bentseenirengas), kun se reagoi pohjalla, muodostaa bentsoaatin suolat. Kaikissa karboksiloinnissa ryhmä -Co- Edustaa (rax).
Litium diaquilcupratos
Litiumpäivä on hyödyllinen orgaanisessa synteesissä. Sen kaava on [r-cu-r]-Li+, jossa kupariatomilla on negatiivinen kuorma. Tässä kupari edustaa kuvan atomia.
Sulfoniumsuolat
Ne muodostuvat orgaanisen sulfidin reaktiosta alkyylihalogenidin kanssa:
R -2S + r'x => r2R: t+X
Näille suoloille rikkiatomilla on positiivinen muodollinen kuorma (S+) Otetaan kolme kovalenttisia linkkejä.
Oksiosuolat
Samoin eetterit (sulfidien hapetetut analogit) reagoivat hydraseidien kanssa oksihuoneiden muodostamiseksi:
Ror ' + Hbr ro+Hr ' + br-
HBR -happoprotoni on jatkuvasti yhteydessä eetterihappiatomiin (R2JOMPIKUMPI+-H), lataus se positiivisesti.
Amina -suolat
Amiini voi olla ensisijainen, toissijainen, tertiäärinen tai kvaternäärinen, aivan kuten niiden suolat. Kaikille on ominaista, että typpiatomiin kytketty H -atomi on H -atomi.
Siten RNH3+X- Se on ensisijainen amiinisuola; R -2Nh2+X-, toissijainen Amina; R -3Nh+X-, korkea -asteen amiini; ja r4N+X-, kvaternääristä amiini (kvaternäärinen ammoniumsuola).
Diatsoniumsuolat
Lopuksi diatsoniumsuolat (RN2+X-tai arildiatsonium (RNA2+X-), ne edustavat monien orgaanisten yhdisteiden, erityisesti atsoisten väriaineiden lähtökohtaa.
Viitteet
- Francis a. Kilpikonnan. Orgaaninen kemia (kuudes painos, PP. 604-605, 697-698, 924). MC Graw Hill.
- Graham Solomons t.W -., Craig B. Freedle. Orgaaninen kemia. Amies (10. painos.-A. Wiley Plus.
- Wikipedia (2018). Suola (kemia). Otettu: sisään.Wikipedia.org
- Steven a. Hardinger (2017). Orgaanisen kemian kuvitettu sanasto: suolat. Palautettu: Chem.UCLA.Edu
- Chevron Oronite (2011). Karboksylaatit. [PDF]. Toipunut: Oroniitti.com

