Ominaisuudet, tyypit ja funktiot selectins
- 1992
- 346
- Gustavo Runte DVM
Se Valinta Ne ovat polypeptidiketjujen muodostavien glykoproteiinien perhe, jotka tunnistavat sokerien spesifiset konformaatiot (hiilihydraatit), jotka sijaitsevat muiden solujen pinnalla ja sitoutuvat niihin. Tästä syystä niitä kutsutaan myös adheesiomolekyyleiksi.
Nämä tarttumisreseptorit tunnetaan säilyneestä rakenteestaan. He esittävät kolme verkkotunnusta ja kolme erilaista glykoproteiinia. Ne voidaan ekspressoida pintamolekyyleinä, sen lisäksi, että ne säilyyvät tai toimivat liukoisina molekyyleinä.
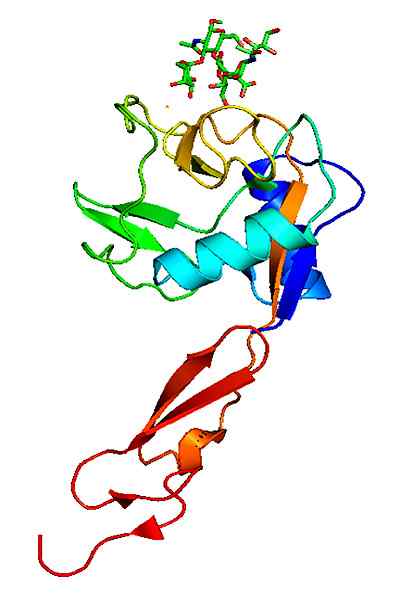
 P-selektiinin molekyylirakenne. Otettu ja muokattu osoitteesta: Neveu, Curtis [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)].
P-selektiinin molekyylirakenne. Otettu ja muokattu osoitteesta: Neveu, Curtis [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Päinvastoin kuin muut tarttuvuusmolekyylit, selectins toimii vain valkosolujen vuorovaikutuksissa verisuonten endoteelin kanssa.
[TOC]
Ominaisuudet
Selectins ovat kaikki proteiineja, jotka sisältävät ketjun oligosakkarideja, yhdistävät kovalenttiset sidokset sivuttaisina aminohappiketjuihin (glykoproteiinit). Ne ovat transmembraanisia molekyylejä, mikä tarkoittaa, että ne ylittävät lipidikarjan.
Niillä on ominaisuudet, jotka ovat hyvin samankaltaisia kuin CLEC- tai LECTINAS -tyypin C -proteiinit. Koska tyypin C lektinina Selectins vaatii kalsiumioneja risteyksen suorittamiseksi.
Sanan "Selectin" alkuperä viittaa tosiasiaan, että nämä proteiinit ekspressoivat selektiivisesti verisuonisoluissa ja sisältävät myös lektiinidomeenin.
Jotkut kirjoittajat sisältävät selectins (glykoproteiinit) lektinoihin, koska ne ovat molekyylejä, jotka sitoutuvat sokereihin. Muut kirjoittajat kuitenkin erottaavät ne käsitteen alla, että lektinat tunnistavat vain hiilihydraatit ja liittyvät niihin, kun taas Selectins ei vain tunnista ja liity sokereita, vaan myös hiilihydraatit muodostavat ne myös hiilihydraatit.
Selectins-säätely tapahtuu transkriptionaalisella tasolla proteolyyttisen prosessoinnin kautta, solujen luokituksella ja glykosilin-transferaasien säädetyillä ekspressioilla.
Selectiinillä on lyhyt solunsisäinen verkkotunnus. Heillä on kuitenkin kolme solunulkoista domeenia, epidermaalisen kasvutekijän tyypin domeeni, tyypin C lektiinin domeeni ja toistoyksiköt, samanlainen kuin komplementin säätelyproteiinit.
Voi palvella sinua: HELE -solut: Historia, ominaisuudet, solusykli ja käytötKaverit
Selectin -perhe koostuu kolmesta erityyppisestä glykoproteiinista. Jokainen näistä tunnistetaan kirjeellä, joka tarkoittaa paikkaa, jossa ne ensin tunnistettiin. Seuraavaksi näemme jokaisen heistä.
L-selektiini
Se tunnetaan myös nimellä SALL, CD62L, LAM1, LEU8, LNHR, LSEL tai TQ1. Sitä löytyy leukosyyteistä, joten Selectinin "L". Se on solun pintakomponentti. Kolme domeenia ovat: lektinojen vastine, epidermaalinen kasvutekijä ja kaksi toistoyksikköä konsensus.
Se esittelee useita ligandeja, ts. Yleensä pieniä molekyylejä, jotka muodostavat kompleksin biomolekyylin kanssa, tässä tapauksessa proteiini. L-selektiinin tunnettuja ligandeja ovat seuraavat.
Glycam1
Glykosylaatiosta riippuvaisen solujen tarttumisen molekyylimolekyyli -1.
CD34
Se on fosfographoproteiini, joka havaitaan useissa nisäkkäiden ryhmissä, kuten ihminen, rotat ja hiiret, muun muassa. Sitä kuvattiin ensin hematopoieettisissa kantasoluissa. Niitä löytyy useista soluista, mutta se liittyy melkein yksinomaan hematopoietiikkaan.
Madcam-1
Tunnetaan nimellä AD -hartsi- tai solu -adheesiomolekyyli verisuonen limakalvon suuntaan (englanniksi verisuonen limakalvon osoite solujen tarttumisen molekyyli 1). Se on endoteelin solunulkoinen proteiini, joka on vastuussa määrittämisestä, missä kudoksessa lymfosyyttit tulevat, sokerien kantamisen lisäksi niin, että L-selektiini tunnistaa ne.
PSGL-1
Muiden synonyymien keskuudessa nimellä SELPLG tai CD162, se on glykoproteiini, jota löytyy endoteelisoluista ja leukosyyteissä. Voit liittyä kahteen muuhun tyyppiin Selectins. Vaikuttaa kuitenkin siltä, että se on parempi affiniteetti p-selektiiniin.
Voi palvella sinua: sienisolut: ominaisuudet, organelit ja toiminnotP-selektiini
P-selektiini tunnetaan muilla nimillä, kuten SELP, CD62, CD62P, GMP140, GRMP tai LECAM3. Se sijaitsee endoteelisolujen pinnalla, jotka peittävät verisuonten ja verihiutaleiden sisäiset marginaalit.
P-selektiini tunnistettiin ensimmäistä kertaa verihiutaleissa. Siksi proteiinin nimi kantaa alkuperäisen "p".
P-selektiinin rakenne koostuu domeenista, joka on hyvin samanlainen kuin tyypin C lektiini n EGF-päässä; toisin sanoen noin 30–40 aminohappojätteen säilytetty proteiinidomeeni, jossa on kaksikariainen β-lehte.
Se esittelee kolmannen domingin, joka on samanlainen kuin komplementtiproteiini, jota kutsutaan, kuten Cub -domeeni, jolle on ominaista proteiinidomeeni säilynyt evoluutiossa ja esittämällä noin 110 aminohappojätteen jätettä.
P-selektiinin suurempi affiniteetti ligandi on PSGL-1, kuten aiemmin on kuvattu L-selektiiniligandeissa. Toisaalta tämä proteiini voi muodostaa myös komplekseja muiden molekyylien, kuten sulfatoituneen polysakkaridin kanssa, nimeltään fucoidan ja heparán -sulfaatti.
E-selektiini
Tämä Selectin -proteiini tunnetaan myös seuraavilla nimillä: SELE, CD62E, Elam, Elam1, Esel, Lecam2 ja muut. Se ekspressoituu yksinomaan endoteelisoluissa, jotka aktivoidaan pienillä proteiineilla, jotka eivät pysty ylittämään solun lipidikerroksista, nimeltään sytokiinit.
Tämän proteiinin rakenne koostuu kolmesta domeenista (kuten muusta Selectinsistä): Domeeni, joka on samanlainen kuin EGF, 6 yksikköä kontrolliproteiinimoduuleja (joita kutsutaan myös sushi -domeeneihin) toistuvan SCR: n ja läpäisevän domeenin transhi -domeenien kanssa.
Se voi palvella sinua: megakariosyyttit: ominaisuudet, rakenne, muodostuminen, kypsyminen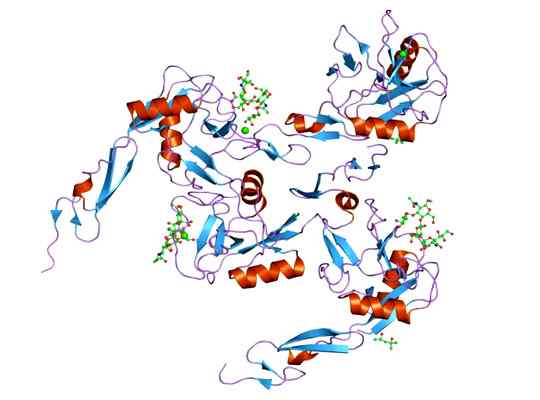 E-selektiiniproteiinin molekyylirakenteen esitys, jonka domino on EGF. Otettu ja toimitettu: Jawahar Swaminathan ja MSD: n henkilökunta Euroopan bioinformatiikan instituutissa [julkinen verkkotunnus].
E-selektiiniproteiinin molekyylirakenteen esitys, jonka domino on EGF. Otettu ja toimitettu: Jawahar Swaminathan ja MSD: n henkilökunta Euroopan bioinformatiikan instituutissa [julkinen verkkotunnus]. Ligandi, joka muodostaa komplekseja E-selektiivisen kanssa, on melko monipuolinen, mutta erottuvat ovat seuraavat.
Sialyyli-lewis a
Kutsutaan myös SLE A O CA19-9. Se on tetrasakkaridi syöpäpotilaiden seerumeissa. Sen tiedetään osallistuvan solujen tunnistusprosessiin. Se ilmenee konstitutiivisesti granulosyyteissä, monosyyteissä ja lymfosyyteissä T.
Sialyyli-Lewis x
Se on myös tetratasakkaridi, kuten sialyyli-lewis a, ja sillä on samanlaiset toiminnot. Se ilmenee granulosyyteissä ja monosyyteissä ja hallitsee näiden solujen ei -toivottua poistumista tai vuotoa tulehduksen aikana.
PSGL-1
Vaikka P-selektiinissä on ilmeisesti tehokkaampaa, jotkut kirjoittajat katsovat, että ihmisen neutrofiileistä peräisin oleva muoto on myös melko tehokas E-selektiinissä. Itse asiassa he ajattelevat, että yleensä tämä ligandi on olennainen kolmen tyyppisille Selectins -tyypeille.
Funktio
Selectins -päätehtävä on olla osa valkosolujen muodostumisprosessia (lymfosyytit). He osallistuvat myös immuunivasteeseen, kroonisiin ja akuuteihin tulehduksiin kehon eri elimissä, kuten munuaiset, sydän ja iho. Ne toimivat jopa syöpää aiheuttavien metastaasien tulehduksellisissa prosesseissa.
Viitteet
- Valinta. Haettu: vuonna.Wikipedia.org.
- L-selektiini. Haettu: vuonna.Wikipedia.org.
- CA19-9. Haettu: vuonna.Wikipedia.org.
- E-selektiini. Haettu: vuonna.Wikipedia.org.
- X. Zou, v.R -. Shinde patil, n.M. Dagia, l.-Lla. Smith, m.J -. Wargo, k.-Lla. Interliggi, c.M. Lloyd, D.F. Tees, b. Walcheck, m.B -. Lawrence, D.J -. Goetz (2005). Ihmisen neutrofiileistä hylätty PSGL-1 on korkean tehokkuus ligandi Edoteeli-ekspressin E-selektiinille virtauksen alla. American Journal of Physiology. Solufysiologia.
- K -k -. Laki (2001). Selectins -toiminnot. Tulokset ja ongelmat solujen erilaistumisessa.
- Valinta. Toipunut: Wellpath.Uniovi.On.
- J -.H. Pérez & C.J -. Montoya. Adheesiomolekyylit. Haettu: Encolombia.com.
- -Lla.C. Sanguineti & J.M Rodríguez-Tafur (1999). Tarttuvuus- ja ihomolekyylit. Perulainen dermatologia.
- T.F. Tedder, D.-Lla. Seeber, a. Chen, p. Engel (1995). Selectins: Vaskulaarinen tarttuvuusmolekyylit. Faseb -lehti.
- « Valkoiset mangrove -ominaisuudet, elinympäristö, taksonomia, käyttää
- Integriinin ominaisuudet, rakenne ja toiminnot »

