SGLT (natrium-glukoosi kuljetusproteiinit)
- 1264
- 223
- Gabriel Fahey
Se Natrium-glukoosi kuljetusproteiinit (SGLT) He vastaavat aktiivisen glukoosikuljetuksen suorittamisesta nisäkässoluissa pitoisuusgradienttia vastaan. Tämän kuljetuksen mahdolliseksi tarvittava energia hankitaan natrium cotransportista samaan suuntaan (Simport).
Sen sijainti on rajoitettu solujen kalvoon, jotka muodostavat epiteelikudokset, jotka ovat vastuussa ravinteiden imeytymisestä ja imeytymisestä (ohuet suolet ja munuaisen proksimaalinen muotoiltu putki).
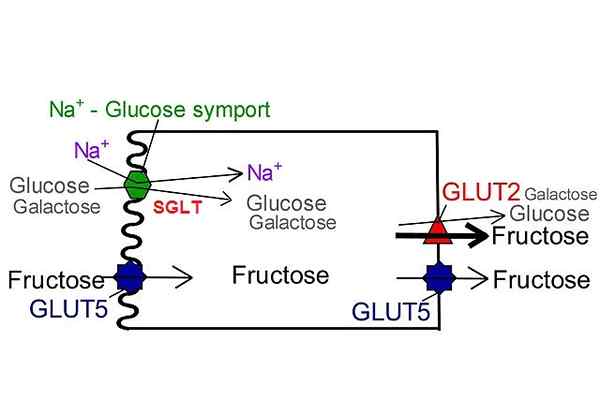
 SGLT -glukoosin kuljettajat toisin kuin glut. NUFS, San Jose State University [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)], muokattu Wikimedia Commons.
SGLT -glukoosin kuljettajat toisin kuin glut. NUFS, San Jose State University [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)], muokattu Wikimedia Commons. Tähän päivään mennessä on kuvattu vain kuusi tähän kuljetusperheeseen kuuluvia isomuotoja: SGLT-1, SGLT-2, SGLT-3, SGLT-4, SGLT-5 ja SGLT-6. Kaikissa niissä natriumionin kuljetuksen tuottama sähkökemiallinen virta tarjoaa energiaa ja indusoi tarvittavan proteiinin rakenteen konformaatiomuutoksen metaboliitin siirtämiseksi kalvon toisella puolella.
Kaikki nämä isoformit eroavat toisistaan esittämällä eroja:
- Affiniteetin aste, joka heillä on glukoosille,
- Kyky suorittaa glukoosi-, galaktoosi- ja aminohappojen kuljetus,
- Missä määrin Florizina ja
- Kudoksen sijainti.
[TOC]
Glukoosikuljetuksen molekyylimekanismit
Glukoosi on kuuden hiiliatomien monosakkaridi.
Koska sen koko on suuri ja olennaisesti hydrofiilite, se ei pysty ylittämään solukalvoja vapaasti diffuusiolla. Siksi sen sytosolin mobilisointi riippuu kuljetusproteiinien esiintymisestä näissä kalvoissa.
Tähän mennessä tutkitut glukoosin kuljettajat suorittavat tämän metaboliitin kuljetuksen passiivisilla tai aktiivisilla kuljetusmekanismeilla. Passiivinen kuljetus eroaa aktiivisesta kuljetuksesta, jossa se ei vaadi energian tarjontaa, koska se tapahtuu pitoisuusgradientin hyväksi.
Se voi palvella sinua: sipulin orvaskeusPassiiviseen glukoosikuljetukseen osallistuvat proteiinit kuuluvat levitettyjen levitettyjen kuljetuslaitteiden perheeseen, jota kutsutaan lyhenteenä englanniksi termillä "glukoosin kuljettajat". Kun taas niitä, jotka suorittavat sen aktiivista kuljetusta, on kutsuttu SGLT: lle "natrium-glukoosin kuljetusproteiinit".
Jälkimmäinen saa tarvittavan vapaan energian glukoosin kuljetuksen suorittamiseksi natrium -ioni -cotransportin pitoisuusgradienttia vastaan. Ainakin 6 SGR -isomuotoa on tunnistettu ja sen sijainti näyttää rajoittuvan epiteelisolukalvoihin.
SGLT -ominaisuudet
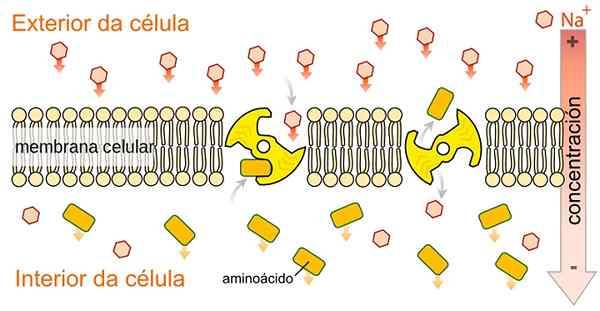 SLGT -simport -kouluttajat eivät ole spesifisiä glukoosille, ne kykenevät kuljettamaan toisen valikoiman metaboliitteja, kuten aminohappoja, galaktoosia ja muita metaboliitteja, koska ne käyttävät natrium -ioni -cotransportin vapauttamaa energiaa niiden pitoisuusgradientin hyväksi. Kirjoittanut SpecilaDyofhats [CC0 (https: // creativecommons.Org/lisenssit/by-SA/4.0), Wikimedia Commons.
SLGT -simport -kouluttajat eivät ole spesifisiä glukoosille, ne kykenevät kuljettamaan toisen valikoiman metaboliitteja, kuten aminohappoja, galaktoosia ja muita metaboliitteja, koska ne käyttävät natrium -ioni -cotransportin vapauttamaa energiaa niiden pitoisuusgradientin hyväksi. Kirjoittanut SpecilaDyofhats [CC0 (https: // creativecommons.Org/lisenssit/by-SA/4.0), Wikimedia Commons. Kuten sen nimellä on osoitettu, natrium-glukoosi kuljetusproteiinit suorittavat natrium- ja glukoosin tai natrium- ja galaktoosityyppisen sytosolin Simport-tyyppiä solusytosoliin.
Natriumkuljetus pitoisuusgradientin hyväksi on vastuussa välttämättömän vapaan energian tuottamisesta glukoosin mobilisoimiseksi matalasta pitoisuusvyöhykkeestä korkeaan pitoisuuteen.
Nämä kuljettajat ovat osa natriumin ja vedyn anti -transportin ja sympatiaproteiinia, joiden geenit eivät ole fylogeneettisesti sukulaisia.
Sen sijainti on rajoitettu ravinteiden imeytymiseen osallistuvien kudosten epiteelisolujen, kuten ohuen suolen ja proksimaalisen muotoisen putken, epiteelisolujen epiteelisolujen epiteelisolujen epiteelisoluissa.
Voi palvella sinua: Coxiella burnetiiSGLT -tyypit
Tähän mennessä kuusi SGLT-kuljettajaa (SGLT-1, SGLT-2, SGLT-3, SGLT-4, SGLT-5 ja SGLT-6) on tunnistettu. Kaikilla on eroja glukoosin tai galaktoosin kuljettamisen mieltymyksessä, näiden sokerien ja natriumin aiheuttaman affiniteetin ja Florizinan estävän tosiasian vuoksi.
SGLT1: llä on kyky kuljettaa galaktoosia glukoosin lisäksi hyvin samanlaisella kinetiikalla, kun taas SGLT2 kuljettaa vain glukoosia.
GSLT -rakenne
SGLT -proteiinien peptidisekvenssin pituus vaihtelee välillä 596 - 681 aminohappojätettä. Samaan aikaan sekvenssien väliset homologiaprosentit vaihtelevat välillä 50-84 % suhteessa SGLT-1: hen, mikä on suurin ero sekvensseissä, jotka vastaavat solunulkoista domeenin aminopäätettä ja terminaalia karboksyylia.
Yleinen rakenne on samanaikainen multipaso -integraaliproteiinin, toisin sanoen se ylittää kalvon useita kertoja kalvon läpäisydomeenien kautta, joissa on runsaasti hydrofobisia aminohappoja.
Nämä läpäisevän domeenien on yhteensä 14 ja jokaisella niistä on sekundaarinen rakenne α-Helix. Segmentit 1, 2, 5, 7 ja 9 on alueellisesti järjestetty keskusasentoon, mikä johtaa hydrofiilisen huokosen muodostumiseen.
Hydrofiilisen huokosen kautta kulkee glukoosia, samoin kuin mitä tahansa muuta metaboliitteja, joille kuljettaja voi olla affiniteetti. Jäljellä olevat kierteiset fragmentit on järjestetty rinnakkain, jotta kanavalle annetaan suurempi rakenteelliset stabiilisuus.
SGLT -toiminnot
SGLT -perheenjäsenet eivät osoita ainutlaatuista spesifisyyttä glukoosille. Päinvastoin, he kykenevät aktiivisesti mobilisoitumaan munuaistutkimisolujen ja suoliston epiteelin kalvon läpi monenlaisia metaboliitteja, kuten aminohappoja, ioneja, glukoosia ja osmolyyttejä.
Tämän tyyppisten kuljettajien funktio, jota on tutkittu laajemmin, on virtsassa olevan glukoosin imeytyminen.
Se voi palvella sinua: vertaileva embryologia: mikä se on, mitä tutkimuksia, historiaa, teorioitaTämä imeytymisprosessi käsittää hiilihydraatin mobilisoinnin munuaistutkista putkimaisten epiteelisolujen kautta peritubulaaristen kapillaarien luumeniin. On suuren kapasiteetin ja affiniteetin isoformi glukoosi SGLT-2: een, joka on tärkein veronmaksaja.
Glukoosin absorptiofunktio suolistossa johtuu SGLT-1: lle, kuljettimelle, että alhaisella kapasiteetilla on korkea affiniteetti glukoosiin.
Tämän perheen kolmas jäsen, SGLT3, ekspressoituu luurankojen lihassolujen ja hermoston kalvoissa, joissa se ei näytä toimivan glukoosin kuljettajana, vaan tämän sokerin pitoisuuksien anturina solunulkoisessa väliaineessa.
SGLT4-, SGLT5- ja SGLT6 -isoformien toiminnot eivät ole toistaiseksi olleet varmoja.
Viitteet
- Abramson J, Wright EM. NA -symporterien rakenne ja toiminta kääntemillä toistoilla. Curr Ace Struct Biol. 2009; 19: 425-432.
- Alvarado F, Crane RK. Tutkimukset sokerien suoliston imeytymisen mekanismista. Vii. Fenyyligllykosidikuljetus ja sen mahdollinen suhde foriiniinin estämiseen SUGS: n aktivointikuljetusten estämiseen pienellä laitoksella. Biochim biofysialaki. 1964; 93: 116-135.
- Charron FM, Blanchard MG, Lapointe JY. Solunsisäinen hypertonisuus on vastuussa vesivirrasta, joka liittyy Na_/glykoosin cotransportiin. Biophys J. 2006; 90: 3546-3554.
- Chen XZ, Coady MJ, Lapointe JY. Nopeajännitteen kiinnityslevit NA_-glukoosin cotransporterin pitkä- ja tilavirtojen uuteen komponenttiin. Biophys J. 1996; 71: 2544-2552.
- Dyer J, Wood IS, Palejwala A, Ellis A, Shirazi-Beeecey SP. Monosakkaridikuljettajien ilmentyminen diabeetikoiden suolistossa. Am J Physiol -maha -arvon maksafysioli. 2002; 282: G241-G248.
- Sátk M, Marks J, Unwin RJ. SLC5 -perheenjäsenen SGLT3: n oletettu kudoksen sijainti ja toiminta. Fysioli. 2017; 102 (1): 5-13.
- Turk E, Wright EM. Membraanin topologian aiheet SGG Cotransporter -perheessä. J Memb Biol. 1997; 159: 1-20.
- Turk E, Kim O, hän J, Whitelegge JP, Eskandari S, Lam JT, Kreman M, Zampighi G, Faull KF, Wright EM. Molekyylin karakterisointi Vibrio parahaemolyticus VSGLT: Malli natrium kytketyille sokerikerroksille. J Biol Chem. 2000; 275: 25711-25716.
- Taroni C, Jones S, Thornton JM. Hiilihydraattien sitoutumiskohtien analysointi ja ennustaminen. Eng -proteiini. 2000; 13: 89-98.
- Wright EM, Loo DD, Hirayama Ba. Ihmisen natriumglukoosin kuljettajien biologia. Fysioli Rev. 2011; 91 (2): 733-794.
- « Maan magnetosfäärin ominaisuudet, rakenne, kaasut
- Magneettiset laskuelementit ja maapallon magneettikenttä »

