Kiteiset kiinteät rakenteet, ominaisuudet, tyypit, esimerkit

- 816
- 27
- Gabriel Fahey
Se kiteinen kiinteä aine Ne ovat niitä, joiden mikroskooppiset rakenteet on tilattu ja noudattaa tietylle kiteiselle verkolle erottuvaa kuviota; Esimerkiksi: kuutio, kuusikulmainen, trikliininen, rhomboédrica, muun muassa.
Sanotaan, että nämä kiintoaineet ovat olemassa kiteinä, jotka osoittavat puolia ja geometrisiä malleja, jotka heijastavat kuinka järjestetään sisällä. Muita esimerkkejä kiteisistä kiinteistä aineista ovat timantti, kvartsi, antraseeni, kuiva jää, kaliumkloridi tai magnesiumoksidi.
 Rikoskiteinen baari. Lähde: Pixabay.
Rikoskiteinen baari. Lähde: Pixabay. Pari erittäin tunnettuja kiteisiä kiinteitä aineita on sokeri ja suola (NaCl). Ensi silmäyksellä molemmat käyttävät valkoisia kiteitä; Mutta sen ominaisuudet eroavat suuresti. Sokeri on molekyylin kiteinen kiinteä, kun taas suola on ioninen kiteinen kiinteä aine. Ensimmäinen koostuu sakkaroosimolekyyleistä; Ja toinen, Na -ioneista+ ja cl-.
Yläkuvan avulla voit vilkaista kuinka kirkkaat sokerikiteet voivat olla. Suolakiteet, mutta ne eivät ole kaukana. Vaikka sokeri ja suola näyttävät veljiltä, niiden rakenteet ovat erilaisia: sokerilla, josta tulee sakkaroosi, on monokliininen rakenne; Suolaa, kuutiometriä.
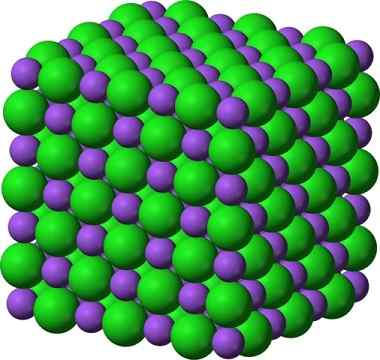 Natriumkloridin kiteinen rakenne, NaCl
Natriumkloridin kiteinen rakenne, NaCl Suihkutettu sokeri ja suola (GLAS) pysyvät kiteisinä; Hänen kiteistään on tullut vain paljon pienempiä silmillemme. Siksi kiinteän aineen kiteisyys määrittelee enemmän sen sisäisen rakenteen kuin sen ulkoisen ulkonäön tai sen kimaltelevuuden avulla.
[TOC]
Kiteisten kiintoaineiden rakenne
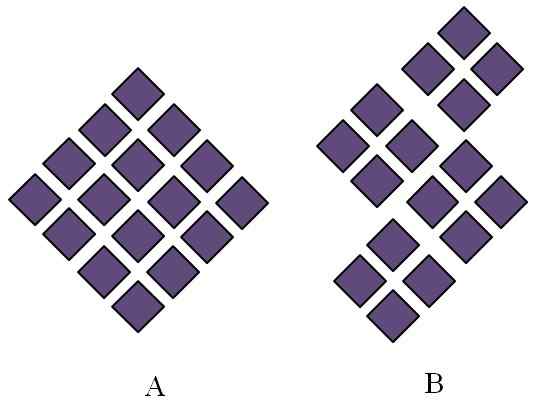 Kiteisten kiintoaineiden järjestetyt rakenteet. Lähde: Gabriel Bolívar.
Kiteisten kiintoaineiden järjestetyt rakenteet. Lähde: Gabriel Bolívar. Kiteiset kiinteät aineet ovat tilanneet rakenteet. Sen geometriset ominaisuudet riippuvat kiteisen verkon tyypistä, johon ne kuuluvat, mikä puolestaan projisoidaan ulkoisesti kideen muodoissa (kiteinen järjestelmä). Ylivoimainen kuva kuvaa kahta tärkeää käsitettä tällaisista rakenteista: jaksollisuus ja kiteiset jyvät.
Voi palvella sinua: hajauttamisvaiheKiteisen kiinteän kiinteiden hiukkasten alueellinen järjestelmä on sanomalehti; eli se toistetaan uudestaan ja uudestaan kaikkiin suuntiin. Tämä aiheuttaa oman rakenteellisen kuvion jokaiselle kiinteälle ja kiteiselle verkkolle; Esimerkiksi, tässä suola ja sokeri alkavat erottua sen kemiallisen luonteen ulkopuolella.
Rhombusissa heidät käsketään aiheuttamaan suurempien mittasuhteiden rhombus. Jokainen violetti rhombus edustaa hiukkasia tai joukko niitä (atomit, ionit tai molekyylit). Siten voidaan odottaa, että A: n makroskooppisella kristallilla on rhomboédica -ulkonäkö.
Samaan aikaan B: ssä rhombusit tilataan siten, että ne ovat kiteisiä jyviä; Nämä ovat hyvin pieniä kiteitä (kristalliitit). Sitten sanotaan, että B on polyristaalinen kiinteä; toisin sanoen sen muodostuu agglomeraatio useita kristalliiteja.
Yhteenvetona voidaan todeta, että kiinteä aine voi olla yksinkertaisesti kiteinen (A) tai polyristaliini (B); Muodossa kiteissä, kun taas B -polyristales.
Ominaisuudet
Kiteisten kiintoaineiden ominaisuudet riippuvat sen tyypistä. On tiedossa, että heidän rakenteensa on tilattu ja että he yleensä esittävät myös loistavia ryhmiä, jotka rakastuvat mineraalien ystäville. Mainittiin kuitenkin, että kiinteä pölyinen, mukaan lukien "pois", voidaan myös luokitella kiteiseksi.
Tapa, jolla niiden hiukkaset ovat spatiaalisesti suuntautuneet. Esimerkiksi kiteiset kiinteät aineet kykenevät diffraktioon x -rakoihin, luomalla diffraktiospektrit, joista kiteen mikroskooppinen rakenne voidaan määrittää.
Samoin, koska rakenne on jaksollinen, lämpö levitetään samalla tavalla kiinteässä; niin kauan kuin välissä ei ole epäpuhtauksia. Siten kiteisen kiinteän aineen sulamispisteet ovat vakioita, eivätkä ne vaihtele riippumatta siitä, kuinka ne mitataan.
Se voi palvella sinua: gallium: ominaisuudet, rakenne, hankkiminen, käyttöKiteisten kiintoaineiden tyypit
Kiteisten kiinteiden aineiden tyypit perustuvat siihen, minkä tyyppiset hiukkaset koostuvat ja mitkä ovat niiden vuorovaikutukset tai linkit. Tyyppiä on neljä: ioniset, metalliset, molekyyli- ja kovalenttiset verkot.
Jopa silloin, kun he esittävät tietyn asteen epäpuhtauksia, ne ovat edelleen kiteisiä, vaikka niiden ominaisuudet vaikuttavat ja eivät osoita samoja odotettuja arvoja puhtaalle kiinteälle.
Ioninen
Suola on esimerkki ionisesta kiteisestä kiinteästä aineesta, koska se koostuu Na -ioneista+ ja cl-. Siksi tämän tyyppisissä kiinteissä aineissa ioninen sidos hallitsee: rakenteellista järjestystä hallitsevat sähköstaattiset voimat.
Metalli
Kaikki metalliatomit muodostavat metallikiteitä. Tämä tarkoittaa, että esimerkiksi hopeahaarukka on sulatettujen hopeakiteiden ryhmittymä. Sisäinen tai mikroskooppinen rakenne on sama esineen jokaisessa kämmenessä ja pysyy muuttumattomana haarukan kahvasta hampaiden kärkeen.
Molekyyli-
Sokeri on esimerkki molekyylin kiteisestä kiinteästä aineesta, koska se muodostuu sakkaroosimolekyyleistä. Siksi tämäntyyppinen kiinteä aine koostuu molekyyleistä, jotka niiden molekyylien välisen vuorovaikutuksen (ja ei -kovalenttiset sidokset) avulla onnistuvat luomaan järjestetyn rakenteen.
Kovalenttiset verkot
Lopuksi meillä on kovalenttisia verkkoja kiteisiä kiinteitä aineita. Ne hallitsevat kovalenttisia sidoksia, koska ne ovat vastuussa tilauksen luomisesta ja atomien ylläpidosta. Ioneista, atomeista tai molekyyleistä ei ole puhetta, vaan kolmen dimensioisen verkon.
Esimerkit
Seuraavaksi ja lopuksi, joitain esimerkkejä mainitaan jokaiselle kiteisen kiinteän aineen tyypille.
Voi palvella sinua: elektronegatiivisuusIoninen
Kaikki suolat ovat ionisia kiintoainetta. Siellä on myös sulfideja, hydroksideja, oksideja, halogenideja ja muita yhdisteitä, jotka muodostuvat myös ioneilla, tai niiden vuorovaikutukset ovat ionisessa olemuksessa. Meillä on:
-Kcl
-Kotelo4
-Ba (OH)2
-Cuso4
-FECL3
-Naa2S
-Mgoa
-Kahvila2
-Nahco3
-(NH4-A2Kro4
Näiden esimerkkien lisäksi valtaosa mineraaleista pidetään ionisia kiteisiä kiinteitä aineita.
Metalli
Mikä tahansa metallinen elementti esitetään luonnollisesti metallikiteinä. Jotkut niistä ovat:
-Kupari
-Rauta
-Alumiini
-Kromi
-Metallinen vety (kuvittelemattomat paineet)
-Volframi
-Zirkonium
-Titaani
-Magnesium
-Natrium
Molekyyli-
Molekyylin kiteisiä kiinteitä aineita on laaja valikoima. Lähes mikä tahansa orgaaninen yhdiste, joka jähmettyi, onnistuu luomaan kiteitä, jos sen puhtaus on korkea, tai jos sen rakenne ei ole liian monimutkainen. Joten meillä on:
-Jää (h2JOMPIKUMPI)
-Kuiva jää (yhteistyö2-A
-Yllyttää2
-P4
-S8 (ja sen polymorfit)
-Antraseeni
-Kiinteä happi
-Kiinteä ammoniakki
-Fenolftaleiini
-Bentsoehappo
Kovalenttiset verkot
Ja lopuksi, joidenkin kiteisten kiinteiden verkojen kiista -aineiden joukossa, joita meillä on:
-Timantti
-Grafiitti
-Hiilinanoputket
-Fullerenos
-Kvartsi
-Pii
-Germanium
-Boorinitride
Tästä luettelosta hiilinanoputkia ja fullereeniä voitaisiin pitää myös molekyylikiteinä kiinteinä aineina. Tämä johtuu siitä, että vaikka ne koostuvat kovalenttisesti yhtenäisistä hiilihiiliatomeista, ne määrittelevät yksiköt, jotka voidaan visualisoida makromolekyyleiksi (jalkapallopallot ja putket).
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Wikipedia. (2020). Kristalli. Haettu: vuonna.Wikipedia.org
- Kemian librettexts. (16. kesäkuuta 2019). Kiteiset ja amorfiset kiinteät aineet. Palautettu: Chem.Librettexts.org
- Rachel Bernstein ja Anthony Carpi. (2020). Kiinteiden aineiden ominaisuudet. Toipunut: VisionLearning.com
- « Amorfinen kiintoaine rakenne, ominaisuudet, esimerkit
- Demografiset räjähdyksen syyt, seuraukset, edut, haitat »

