Hypertoninen ratkaisu
- 4718
- 1351
- Eddie Hackett
Selitämme, mitkä hypertoniset ratkaisut ovat, niiden ominaisuudet, mitkä ovat käyttöerot hypotonin kanssa ja annamme useita esimerkkejä
Monet ovat yllättyneitä tietäessään, että tapa, jolla kasvit absorboivat vettä juurensa läpi ja tapa, jolla käsien sormet rypistyvät merivedessä, ne ovat läheisesti sukulaisia.
Molemmat asiat tapahtuvat suodattimena toimivan kalvon olemassaolon ja hypertonisen ratkaisun ansiosta, joka kirjaimellisesti imee vettä sen läpi. Mutta mikä on hypertoninen ratkaisu?
Tässä artikkelissa tähän kysymykseen vastataan, ja hypertonisten ratkaisujen merkittävimmät ominaisuudet esitetään, mihin ne ovat, miten ne erotetaan muun tyyppisistä ratkaisuista ja joitain esimerkkejä samasta.
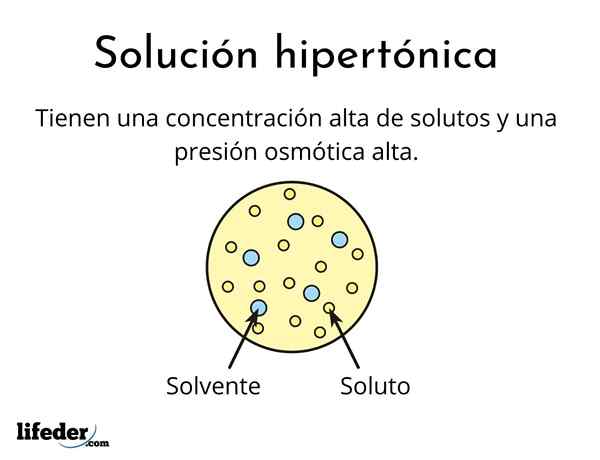
Mikä on hypertoninen ratkaisu?
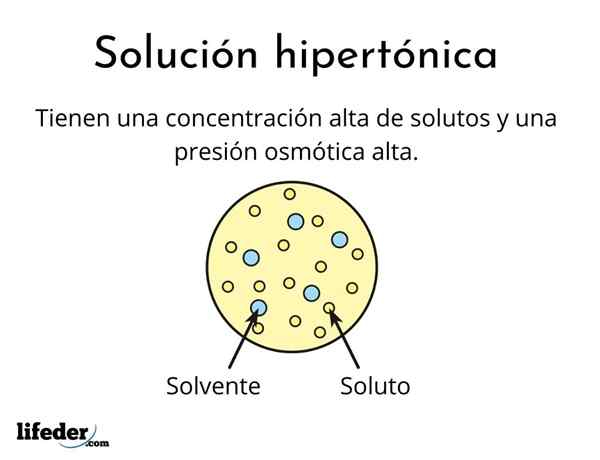
Eräs hypertoninen ratkaisu Se sisältää osmolaarisesti aktiivisten liuenneiden liuenneiden kokonaispitoisuuden suuremmat kuin toinen vertailuliuos. Osmolecal Active tarkoittaa, että liuenneita aineita ei voi ylittää erityistä kalvotyyppiä (samanlainen kuin kangas), joka toimii suodattimena tai suodattimena, ts. Anna veden kulkea, eikä liuenneen hiukkasten kanssa.
Tämä korkea liuenneiden aineiden pitoisuus aiheuttaa hypertonisia liuoksia, joilla on korkea osmoottinen paine. Tämä paine on se, mikä käytännössä imee vettä kalvon läpi, jota kutsutaan osmoosiksi.
Hypertoninen sana tulee kreikkalaisesta etuliitteestä hyper-, joka tarkoittaa "päällä tai" ja "sävyjä", mikä tarkoittaa jännitystä tai painetta, joten hypertoninen tarkoittaa kirjaimellisesti ", että sillä on suurempi paine tai jännitys".
On tärkeää pitää mielessä, että biologiassa ja lääketieteessä edellyttäen, että hypertonisesta ratkaisusta puhuu, se viittaa liuokseen, joka on keskittyneempi kuin veren sisältämä liuos, jota kutsutaan veriplasmaksi.
Hypertonisten ratkaisujen ominaisuudet
Hypertonisilla ratkaisuilla on joitain perusominaisuuksia:
Ne muodostuvat liuottimella ja ainakin yksi liuenneaine
Mikään liuos ei voi olla hypertoninen, vaikka se on hyvin keskittynyt. Liuenneen aineen ei tarvitse ylittää kalvoa, kun taas veden on kyettävä läpäisemään se ilman ongelmia, muuten osmoottinen paine ei tuoteta.
Heillä on korkeat pitoisuudet liuenneita aineita
Tämä tekee heistä hypertonisia ratkaisuja. Kuten hetki sitten mainittiin, hypertoniset liuokset ovat keskittyneempiä kuin veri.
Se voi palvella sinua: Fraktion tislaus: prosessi, laitteet, sovellukset, esimerkitHeillä voi olla erilaisia sävellyksiä
Hypertoninen liuos voi sisältää yhden liuenneen aineen, kuten suola, tai se voi sisältää liuenneita aineita, kuten suoloja ja sokereita, esimerkiksi.
Solutos voi olla ioninen, neutraali tai molemmat
Myynti sisältää ioneja sähkömaksuilla, jotka eivät anna niiden ylittää kalvoa, joten ne ovat pieniä. Muilla liuenneilla aineilla ei ole ioneja, mutta ne ovat suuria ja rasvoja eivätkä sovi reikien läpi.
Heillä on korkea osmoottinen paine
Kuten edellä mainittiin, hypertonisilla liuoksilla on osmoottinen paine suurempi kuin veri.
Ne voivat kuivuttaa soluja
Hypertoniset liuokset uutetaan vesi soluista jättäen ne rusinoita. Siksi kädet ja jalat ryppyiset, kun uimme rannalla.
Mitkä ovat hypertonisia ratkaisuja?
Hypertonic -ratkaisuilla on monia käyttötarkoituksia jokapäiväisessä elämässä ja myös lääketieteessä. Jotkut yleisimmistä käytöistä ovat:
Niitä käytetään ruoan säilyttämiseen
- Esimerkki: Siirappin persikat eivät mätää. Dehydratoivilla soluilla hypertoniset liuokset eivät salli sieniä ja bakteereja ruoassa, koska ne kuolevat janoon. Tämä antaa ruokia kestää enemmän.
Ne vähentävät tulehduksia
- Esimerkki: Kun jollakin on onnettomuus ja osuu päähän, aivoissa on monta kertaa tulehdusta. Potilaan parantamiseksi lääkärit injektoivat 7,5% suolaliuosta. Tämä ratkaisu imee vettä käytännössä vähentäen aivojen tulehduksia.
Ne korvaavat elektrolyyttien.
- Esimerkki: Natrium on elektrolyytti, joka meidän on elävä, ja kun potilaalla on vähän natriumia veressä, injektoidaan 7,5% suolaliuos liuos.
Niitä käytetään parenteraaliseen ruokaan
- Esimerkki: Kun ihmiset eivät voi syödä suun kautta tai putken läpi, he ruokkivat hypertonista liuosta, joka sisältää eräänlaisen sokerin, nimeltään glukoosi.
Erot hypotonisten ja isotonisten ratkaisujen kanssa
Aivan kuten hypertonisia ratkaisuja, on myös hypotonisia ja isotonisia ratkaisuja. Ero jälkimmäisen ja hypertonisen liuoksen välillä on sen pitoisuus. Hypotoniset liuokset ovat niitä, jotka ovat vähemmän keskittyneet kuin veri, ja isotoninen on sama pitoisuus kuin veressä.
Esimerkiksi puhdas vesi, koska siinä ei ole mitään liuennettua, on hypotoninen, kun taas kookosvedessä on suoloja ja sokereita, joiden pitoisuus on melkein yhtä suuri kuin veri, joten se on isotoninen.
Sen lisäksi, että pitoisuutensa erotetaan, hyper-, hypo- ja isotoniset liuokset eroavat toisistaan tapaan, jolla ne vaikuttavat soluihin.
Seuraava kuva näyttää erityyppisten liuosten vaikutuksen punasoluihin (pienet solut, jotka tekevät verestä punaisen).
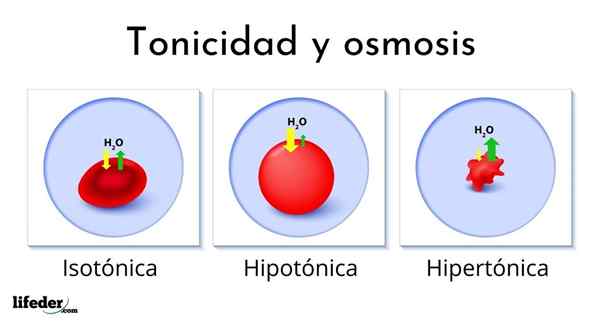
Jos punasolut viedään hypertoniseen liuokseen, seuuttelee vettä, kuivaa ne ja jättää ne ryppyisiksi passiksi.
Toisaalta, jos ne johdetaan hypotoniseen liuokseen, punasolut imevät vettä ja turpoaa, jopa räjähtäen kuin ilmapallo, joka paisuu liikaa. Lopuksi, jos ne johdetaan isotoniseen liuokseen, punasolujen sisällä ja sen ulkopuolella oleva vesi on tasapainossa, joten mitään ei tapahdu.
Esimerkkejä hypertonisista ratkaisuista
Sokerisiirappi
 Persikat siirappissa
Persikat siirappissa Siirappi, jossa persikat ja muut hedelmät säilyvät.
Suolavesi
Suolavesi on vesi- ja suolaliuos, jonka pitoisuudet ovat erittäin korkeat 3,5 - 25%, josta voi tulla melkein 30 kertaa enemmän konsentroitua kuin veri (ts. Se on erittäin hypertoninen).
Etikka
Yleinen etikka on hypertoninen liuos, koska sen pitoisuus on välillä 3% - 5% etikkahappoa. Balsami -etikan vähentäminen on vielä tiivistyneempiä.
Voi palvella sinua: dimetyyliamiini ((CH3) 2NH): rakenne, ominaisuudet, käyttö, riskitSama suonemme veri, kun hikoilu on paljon.
Kun harjoitetaan ja hikoilee, vartalo eliminoi vettä ja suoloja, mutta eliminoi enemmän vettä kuin suolat (hiki on hypotoninen), joten veri keskittyy ja muuttuu hypertoniseksi.
Merivettä
Merivedet sisältävät monia liuenneen suoloja, joiden kokonaispitoisuus on noin 3,5%, mikä tekee siitä hypertonisen. Siksi meriveden rypistyy sormemme.
Sokeriset juomat
Kolajuomat ja muut sokerijuomat voivat sisältää jopa 10% sokeria, samoin kuin suoloja ja muita liuenneita aineita, joiden pitoisuudet ovat suurempia kuin veri.
5% dekstroosiliuosta ja 0,45% natriumkloridia (D5 ½ ns)
Tämä on esimerkki hypertonisesta ratkaisusta, jota käytetään ruokkimaan ihmisiä, jotka eivät yleensä voi syödä suun kautta.
25% mannitoli
Tämä on ratkaisu, jota käytetään usein iskujen hoitamiseen. Se on neljä kertaa enemmän keskittyneempi kuin veri.
7,5% suolaliuosta
Se on melko tiivistetty suolaliuos, johon myös injektoidaan joillakin potilailla, joilla on tiettyjä tauteja suonissa.
Kaupalliset mehut
Kaikilla supermarketista ostetuilla mehuilla ja jotka eivät ole luonnollisia, on erittäin korkeat sokeripitoisuudet, jotka tekevät niistä hypertonisia.
Viitteet
- Sweeney J. Hypernatremian hallinta. Sairaanhoito. Syyskuu 2010; 40 (9): 63.
- Suolaveto. Wikipedia. 2021. Otettu.Wikipedia.org/wiki/suolavesi.
- Merivettä. Wikipedia. 2021. Otettu.Wikipedia.Org/wiki/merivesi.
- Chavaltamrong B, Pidatcha P, Thavisri U. Elektrolyyttit, sokeri, kalorit, juomien osmolaarisuus ja pH. Kaakkois -Aasian J Trop Med kansanterveys. Syyskuu 1982; 13 (3): 427-431.
- 5% dekstroosi ja 0.45% natriumkloridin injektio, USP. FDA. 2006. Otettu AccessData.FDA.Gov/lääkkeetfda_docs/etiketti/2006/017607S123LBL.Pdf.
- Llorente G, Niño MC. Manitoli vs. hypertoninen suolaliuos liuos neuroanestesiassa. Kolumbialainen anestesiologialehti. Tammikuu maaliskuu 2015; 43 (1): 29-39.
- Saints MM, E. Akuutin pötsien maitohappoasidoosin käsittely laskimonsisäisellä hypertonisella natriumkloridilla tai bikarbonaattiliuoksella, joka. Eläinlääketieteen tutkimus. Helmikuu 2020; 128: 24-34.
- Dini-G. E, Abreu-C. JD, López-M. JA. Useiden kulutusjuomien osmolaliteetti. Kliininen tutkimus. Joulukuu 2004; 45 (4).

