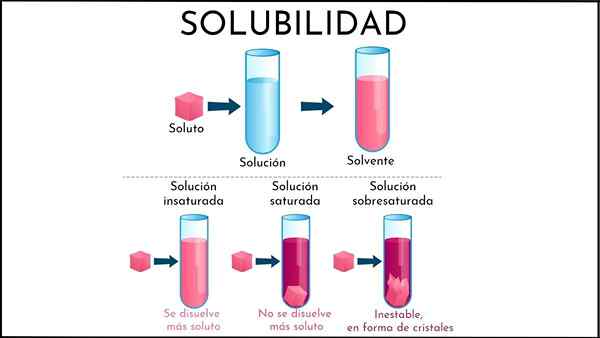
Tyydyttymätön liuos
- 3817
- 1219
- Dr. Travis Reichert
 Tyydyttymättömässä ratkaisussa liuotinpuolisko pystyy edelleen liuottamaan liuenneen aineen
Tyydyttymättömässä ratkaisussa liuotinpuolisko pystyy edelleen liuottamaan liuenneen aineen Mikä on tyydyttymätön ratkaisu?
Eräs tyydyttymätön liuos Se on kaikki liuos, jossa liuotinväliaine pystyy edelleen liuottamaan liuenneen aineen. Tämä väliaine on yleensä nestemäinen, vaikka se voi olla myös kaasumainen. Liuenneen aineen suhteen se on kiinteiden tai kaasumaisten hiukkasten ryhmä.
Ja entä nestemäiset liuenneita aineita? Tällöin liuos on homogeeninen, kunhan molemmat nesteet ovat sekoittuvia. Esimerkki tästä on etyylialkoholin lisääminen veteen; Kaksi nestettä molekyyleillään, Cho3CH2Oi ja h2Tai ne ovat sekoittuvia, koska ne muodostavat vety silloja (valitse3CH2VOI VOI2-A.
Kuitenkin, jos dikloorimetaani sekoittuu (valitse2Cl2) ja vesi, nämä muodostavat liuoksen, jossa on kaksi vaihetta: yksi vesipitoinen ja toinen orgaaninen. Tämä johtuu siitä, että choles of ch2Cl2 ja h2Tai vuorovaikutuksessa erittäin heikosti, joten jotkut liukuvat toisten yli, mikä johtaa kahteen sekoittumattomaan nesteeseen.
Vähimmäispisara CHO: ta2Cl2 (liuennettua) tarpeeksi veden tyydyttämiseksi (liuotin). Jos päinvastoin, ne voisivat muodostaa tyydyttymättömän liuoksen, nähdään täysin homogeeninen liuos.
Tästä syystä vain kiinteät ja kaasumaiset liuenneita aineita voivat tuottaa tyydyttymättömiä ratkaisuja.
Mikä on tyydyttymätön ratkaisu?
Tyydyttymättömässä liuoksessa liuotinmolekyylit ovat vuorovaikutuksessa tehokkuuden kanssa siten, että liuenneen molekyylit eivät voi muodostaa toista vaihetta.
Tämä tarkoittaa, että liuotinsuojaus vuorovaikutukset ylittävät, kun otetaan huomioon paine- ja lämpötila-olosuhteet, liuenneen aiheen tasainen vuorovaikutus.
Kun liuenneen aiheen vuorovaikutukset ovat lisääntyneet, ne "järjestävät" toisen vaiheen muodostumisen. Esimerkiksi, jos liuotinväliaine on neste, ja liuenneen aineen A -aine, toinen liukenee ensimmäiseen muodostaen homogeenisen liuoksen, kunnes kiinteä faasi ilmestyy, mikä ei ole muuta kuin saostettu liuennettu aine.
Se voi palvella sinua: polymetyylimetakrylaattiTämä sakka johtuu tosiasiasta, että liuenneen aineen molekyylit onnistuvat ryhmitelemään kemiallisen luonteensa mukaan, luontaisesti niiden rakenteen tai linkkien suhteen. Kun tämä tapahtuu, sanotaan, että liuos on kyllästynyt liuenneen aineen kanssa.
Siksi tyydyttymätön liuenneaine koostuu nestefaasista ilman saostumista. Vaikka liuenneen aineen kaasumainen, niin tyydyttymättömän liuoksen on oltava vapaa kuplien läsnäolosta (jotka eivät ole muuta kuin virvoitusjuomien klustereita).
Lämpötilavaikutus
Lämpötila vaikuttaa suoraan liuoksen tyydyttymättömyyteen liuenneen aineen suhteen.
Tämä voi johtua pääasiassa kahdesta syystä: lämmönvaikutuksesta johtuvien liuenneen aiheen vuorovaikutusten heikentyminen ja molekyylivärähtelyjen lisääntyminen, joka auttaa leviämään liuenneen aineen molekyylit.
Jos liuotinväliainetta pidetään kompaktina tilana, jonka reikissä liuenneen aineen molekyylit sijaitsevat, lämpötila nousee molekyylit värähtelevät näiden reikien koon lisäämisen; siten, että liuennut aine voi kulkea tiensä muihin suuntiin.
Liukenemattomat kiintoaineet
Joillakin liuenneilla aineilla on kuitenkin niin vahvat vuorovaikutukset, että liuotinmolekyylit kykenevät tuskin erottamaan ne.
Kun näin on, mainitun liuenneen liuenneen aineen minimaalinen pitoisuus riittää sen saostumiseen, ja sitten se on liukenematon kiinteä aine.
Liukenemattomat kiinteät aineet muodostamalla toinen kiinteä kiinteä faasi, joka eroaa nestefaasista, tuottaa vähän tyydyttymättömiä liuoksia.
Esimerkiksi, jos 1L nesteestä A voi liuottaa vain 1 g b: tä saostamatta, niin sekoitettaessa 1L: n A: ta 0.5 g b tuottaa tyydyttymättömän liuoksen.
Se voi palvella sinua: hydrokoloidiSamoin pitoisuusluokka välillä 0 - 1 g B muodostaa myös tyydyttymättömiä ratkaisuja. Mutta 1 g: n jälkeen B saostuu. Kun tämä tapahtuu, liuos siirtyy tyydyttymättömästä kyllästyneeseen B: stä.
Jos kyllästetty liuos 1: llä lähetetään lämmitykseen.5 g b, lämpö auttaa sakan liukenemista. Kuitenkin, jos B: tä on paljon, lämpö ei voi liuottaa sitä.
Jos näin on, lämpötilan nousu vain haihtaisi liuottimen tai nesteen.
Esimerkkejä tyydyttymättömästä ratkaisusta
Esimerkkejä tyydyttymättömistä ratkaisuista on lukuisia, koska ne riippuvat liuottimesta ja liuennesta. Esimerkiksi samoille nesteille A ja muilla liuenneilla aineilla C, D, E… Z, niiden liuokset ovat tyydyttymättömiä niin kauan kuin ne eivät saosta tai muodosta kuplia (jos ne ovat kaasumaisia liuenneita aineita).
-Meri voi antaa kaksi esimerkkiä. Merivedet ovat massiivinen pelastusliuos. Jos asetat kiehua vähän tätä vettä, huomataan, että se on tyydyttymätön saostuneen suolan puuttuessa. Veden haihtuessa liuenneiden ionien alkaminen kuitenkin ryhmitellä, jättäen Saltpeterin kiinni pottiin.
-Toinen esimerkki on hapen liukeneminen meren veteen. O: n molekyyli2 Frank meren syvyydet tarpeeksi hengittämään meren eläimistöä, vaikka se on vähän liukoista.
Tästä syystä on yleistä tarkkailla pintaan nousevia happikuplia; joista muutama molekyyli onnistuu liukenemaan.
Samanlainen tilanne esiintyy hiilidioksidimolekyylin kanssa, CO2. Toisin kuin O2, Yhteistyökumppani2 Se on hiukan liukoisempi, koska se reagoi veden kanssa hiilihapon muodostamiseksi, H2Yhteistyö3.
Voi palvella sinua: MateriaalijärjestelmätEro tyydyttyneellä liuoksella
Yhteenveto äskettäin selitetystä, mitkä ovat erot tyydyttymättömän ja tyydyttyneen liuoksen välillä? Ensinnäkin visuaalinen näkökohta: tyydyttymätön ratkaisu koostuu yksivaiheisesta. Siksi kiinteää (kiinteä faasi) tai kupla ei pitäisi olla läsnä (soodafaasi) ei pitäisi olla.
Myös tyydyttymättömän liuoksen liuenneen pitoisuudet voivat vaihdella, kunnes sakka tai kupla muodostuu. Vaikka kyllästetyissä, kaksisuuntaiset liuokset (nesteen kiinteät tai nesteen kaasumaiset), liuenneen liuenneen aineen pitoisuus on vakiona.
Koska? Koska hiukkaset (molekyylit tai ionit), jotka muodostavat sakan, luovat tasapainon niiden kanssa, jotka ovat liuenneet liuottimeen:
Sakan liuenneen hiukkasten hiukkaset
Kuplamolekyylit liuenneet molekyylit
Tätä skenaariota ei harkita tyydyttymättömiä ratkaisuja. Yritettäessä liuottaa liuennettua ainetta tyydyttyneeseen liuokseen, tasapaino siirtyy vasemmalle; enemmän saostumien tai kuplien muodostumiseen.
Koska tyydyttymättömissä ratkaisuissa tätä tasapainoa (kylläisyys) ei ole vielä muodostettu (kylläisyys) voi "varastoida" kiinteämpää tai kaasua.
Merenpohjan levien ympärillä on liuennut happea, mutta kun happikuplat syntyvät sen lehdistä, se tarkoittaa, että kaasun kylläisyys tapahtuu; Muuten kuplia ei havaittu.
Viitteet
- Yleinen kemia. opetusmateriaali. Lima: Perun pontifinen katolinen yliopisto. Toipunut: Korintti.PUCP.Edu.PE -PE
- Helmestine, Anne Marie, PH.D -d. (2018). Tyydyttymätön ratkaisun määritelmä. Toipunut: Admingco.com
- Tutorvista (S.F.-A. Tyydyttymätön liuos. Otettu: kemia.Ohjaaja.com
- Kemian librettexts (s.F.-A. Kyllästymistyypit. Palautettu: Chem.Librettexts.org
- Nadine James. (2018). Tyydyttymätön ratkaisu: Määritelmä ja esimerkki. Toipunut: Opiskelu.com

