Buteno

- 4963
- 46
- Joshua Emmerich
 Buuteenin kemiallinen rakenne
Buuteenin kemiallinen rakenne Mikä on buteno?
Hän Buteno Se on nimi, joka vastaanottaa neljän isomeerin sarjan kemiallisella kaavalla C4H8. Ne ovat alkeenia tai olefiineja, ts. Heidän rakenteessaan on kaksoissidos C = C. Lisäksi ne ovat hiilivetyjä, joita löytyy öljykerroksista tai jotka ovat peräisin lämpöhalkeilla ja saadaan alemman molekyylipainon tuotteita.
Neljä isomeeriä reagoi happea vapauttavan lämmön ja keltaisen liekin kanssa. Ne voivat myös reagoida laajan spektrin kanssa pieniä molekyylejä, jotka lisätään heidän kaksoissidokseensa.
Mutta mitkä ovat Butenon isomeerit? Yläkuvassa rakenne, jossa on valkoiset pallot (hydrogens) ja mustat (hiilihiilit), on esitetty 1-buteenille. 1-buteeni on hiilivety C: n yksinkertaisin isomeeri4H8.
Huomaa, että on kahdeksan valkoista palloa ja neljä mustaa palloa, mikä on yhtä mieltä kemiallisesta kaavasta.
Kolme muuta isomeeriä ovat cis ja trans 2-buteeni ja iso-buteni. Kaikilla niissä on hyvin samanlaisia kemiallisia ominaisuuksia, vaikka niiden rakenteet aiheuttavat fysikaalisten ominaisuuksien vaihtelua (fuusio- ja kiehumispisteet, tiheydet jne.-A.
Lisäksi niiden spektrillä on samanlaisia absorptiokaistat.
Puhekielisesti, 1-buteeni on nimetty butenoksi, vaikka 1-buteeni viittaa vain yhteen isomeeriin eikä yleiseen nimeen. Nämä neljä orgaanista yhdistettä ovat kaasuja, mutta ne voidaan nesteyttää korkeisiin paineisiin tai tiivisteisiin.
Ne ovat lämmön ja energian lähde, reagenssit muiden orgaanisten yhdisteiden synteesille ja ennen kaikkea välttämättömiä keinotekoisen kumin valmistukseen butadieenin synteesin jälkeen.
Butenon fysikaaliset ja kemialliset ominaisuudet
Molekyylipaino
56.106 g/mol. Tämä paino on sama kaikille kaavan c -isomeereille4H8.
Fyysiset näkökohdat
Se on väritön ja syttyvä kaasu (kuten muutkin isomeerit), ja sillä on suhteellisen aromaattinen haju.
Kiehumispiste
Buteno -isomeerien kiehumispisteet ovat seuraavat:
1 -Buteeni: -6º C
Cis-2-buteeni: 3.7. c
Trans-2-buteeni: 0.96º C
2 -metyylipropeeni: -6.9º C
Sulamispiste
1 -Bute: -185.3. c
CIS-2-Butene: -138.9º C
Trans-2-buteeni: -105.5. c
2 -metyylipropeno: -140.4. c
Liukoisuus
Buteno on hyvin liukenematon veteen sen apolaarisen luonteensa vuoksi. Se kuitenkin liukenee täydellisesti joihinkin alkoholiin, kuten bentseeniin, tolueeniin ja eetteriin.
Tiheys
0 -.577 - 25º C. Siksi se on vähemmän tiheä kuin vesi ja astiassa se sijaitsisi samanlaisen.
Reaktiivisuus
Kuten mikä tahansa alkeeeni, sen kaksoissidos on alttiita molekyylien lisäämiselle tai hapettavalle. Tämä tekee Butenon ja sen isomeerien reaktiivisen. Toisaalta ne ovat palavia aineita, joten ennen lämpötilan ylimääräistä lämpötilaa reagoivat ilman hapen kanssa.
Voi palvella sinua: butanal: rakenne, ominaisuudet, käytöt ja riskitBuuteenin kemiallinen rakenne
Yläkuvassa 1-buteneen rakenne on edustettuna. Vasemmalle näet kaksoissidoksen sijainnin ensimmäisen ja toisen hiilen välillä.
Molekyylillä on lineaarinen rakenne, vaikka C = C -linkin ympärillä oleva alue on tasainen SP -hybridisaation vuoksi2 Näistä hiilihiilistä.
Jos 1-buteenimolekyyli käännettäisiin 180º kulmassa, samalla molekyylillä ei olisi näkyviä muutoksia, joten sillä ei ole optista aktiivisuutta.
Kuinka molekyylisi ovat vuorovaikutuksessa? C-H-, C- ja C-C-linkit ovat apolaarisia luonnetta, joten yksikään niistä ei yhteistyötä dipolimomentin muodostumisessa.
Tämän seurauksena CHO -molekyylit2= CHCH2CH3 Niiden on oltava vuorovaikutuksessa Lontoon hajautusjoukkojen kautta.
Butenen oikea pää muodostaa välittömän dipolin, joka lyhyellä etäisyydellä polarisoi viereisen molekyylin vierekkäiset atomit. Toisaalta linkin C = C vasenpää on vuorovaikutuksessa, joka on päällekkäin pilvien π toisten päällä (kuten kaksi kiekoa tai arkkia).
Koska molekyylin luurankoa muodostavat neljä hiiliatomia, sen vuorovaikutukset ovat tuskin tarpeeksi, jotta nestefaasi olisi kiehumispiste -6º C.
Perustuslailliset ja geometriset isomerit
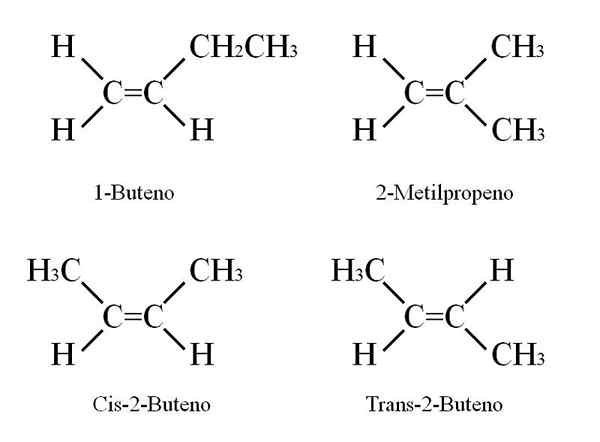 Buenous rakenteet. Lähde: Gabriel Bolívar
Buenous rakenteet. Lähde: Gabriel Bolívar 1-buteenilla on molekyylinen kaava C4H8; Muilla yhdisteillä voi kuitenkin olla rakenteessaan sama osuus C: n ja H: n atomeista.
miten se on mahdollista? Jos 1-buteenin rakenne havaitaan huolellisesti, hiilihiilit substituentit c = c voidaan vaihtaa. Tämä vaihto tuottaa muita yhdisteitä samasta luurankosta.
Lisäksi kaksoissidoksen sijainti C-1: n ja C-2: n välillä voi siirtyä kohti C-2: ta ja C-3: CH: n3Ch = chch3, 2-buteeni.
2-buteenissa H-atomit voidaan asettaa kaksoissidoksen samalle puolelle, joka vastaa cis-stereoisomeeriä; tai vastakkaisessa alueellisessa suuntauksessa, transtereoisomeerissä. Molemmat muodostavat sen, mitä tunnetaan myös nimellä geometriset isomeerit. Sama pätee ryhmiin -CH3.
Samoin huomaa, että jos se jätetään CHO: n molekyyliin3Ch = chch3 H -atomit toisella puolella ja CH -ryhmät3 Toisessa saadaan perustuslaillinen isomeeri: ch2= C (CH3-A2, 2-metyylipropeeni (tunnetaan myös nimellä Iso-Butene).
Voi palvella sinua: kaliumnitraatti (kno3)Näillä neljällä yhdisteellä on sama kaava C4H8 Mutta erilaiset rakenteet. 1-buteeni ja 2-metyylipropeeni ovat perustuslaillisia isomeerejä; ja cis ja trans-2-buteeni, geometriset isomeerit heidän kahden välillä (ja perustuslaillinen suhteessa muihin).
Vakaus
Palamislämpö
Yläkuvasta, mikä neljästä isomeeristä edustaa vakainta rakennetta? Vastaus löytyy esimerkiksi kunkin niiden palamislämpöistä.
Kun reagoi happea, isomeeri kaavan C kanssa4H8 muutetaan CO: ksi2 Veden ja lämmön vapauttaminen:
C4H8(g) + 6o2(g) => 4co2(g) + 4H2O (g)
Poltto on eksoterminen, joten mitä enemmän lämpöä vapautuu, sitä epävakaampi on hiilivety. Siksi neljästä isomeeristä, jotka vapauttavat vähemmän lämpöä polttaakseen ilmassa, on vakain.
Neljän isomeerin palamislämpö on:
-1-buteeni: 2717 kJ/mol
-Cis-2-buteeni: 2710 kJ/mol
-Trans-2-buteeni: 2707 kJ/mol
-2-metyylipropeno: 2700 kJ/mol
Huomaa, että 2-metyylipropeeni on isomeeri, joka antaa vähemmän lämpöä. Kun taas 1-buteeni vapauttaa eniten lämpöä, mikä merkitsee suurempaa epävakautta.
Steerinen ja elektroninen vaikutus
Tämä isomeerien välinen vakausero voidaan vähentää suoraan kemiallisesta rakenteesta.
Alkeenien mukaan se, jolla on eniten substituentteja, hankkii paremman stabiloinnin hänen kaksoissidoksestaan. Siten 1-buteeni on epävakaa, koska sillä on tuskin substituentti (-CH2CH3) Eli se on monosustuido (rhc = cho2-A.
2-buteenin cis- ja transomeerit eroavat energiasta, joka johtuu steerisestä vaikutuksesta peräisin olevan van der-seinämän jännitteestä.
Cis -isomeerissä kaksi ryhmää ch3 Kaksinkertaisen sidoksen samalla puolella he hylkäävät toisiaan, kun taas trans -isomeerissä nämä ovat riittävän kaukana toisistaan.
Mutta miksi sitten 2-metyylipropeeni on stabiilin isomeeri? Koska elektroninen vaikutus välittää.
Tässä tapauksessa, vaikka se on liuennut alkeenin, kaksi CH -ryhmää3 Ne ovat samassa hiilessä; Kummallisessa asennossa toisiaan.
Nämä ryhmät stabiloivat kaksisuuntaisen hiilen, joka antaa sille osan elektronisesta pilvistä (koska se on suhteellisen happamempi SP -hybridisaatiolla2-A.
Lisäksi 2-buteenissa sen kahdessa isomeerissä on vain 2. hiili; Kun taas 2-metyylipropeeni sisältää kolmannen hiilen, suuremmasta elektronisesta stabiilisuudesta.
Voi palvella sinua: Materiaalien rakenne: Konsepti ja esimerkitMolekyylien väliset voimat
Neljän isomeerin vakaus seuraa loogista järjestystä, mutta samaa ei tapahdu molekyylien välisten voimien kanssa. Jos heidän sulatus- ja kiehumispisteitä verrataan, he huomaavat, että he eivät noudata samaa järjestystä.
Odotettaisiin, että trans-2-buteeni esittelee suurimmat molekyylienväliset voimat, jotta kahden molekyylin välillä on suurempi pintakosketus, toisin kuin CIS-2-buteeni, jonka luuranko vetää C: n. CIS-2-buteeni kiehuu kuitenkin korkeammassa lämpötilassa (3.7. c), että trans -isomeeri (0.96º C).
Samanlaiset 1-buteenin ja 2-metyylipropeenin kiehumispisteet odottavat niitä, koska ne ovat rakenteellisesti hyvin samanlaisia. Kiinteässä tilassa ero muuttuu kuitenkin radikaalisti. 1 -buteeni sulaa -185.3º C, kun taas 2 -metyylipropeeni -140.4. c.
Lisäksi CIS-2-buteni-isomeeri sulaa -138: een.9º C, lämpötilassa, joka on hyvin lähellä 2-metyylipropeenia, mikä voi tarkoittaa, että kiinteässä muodossa heillä on yhtä vakaa järjestely.
Näistä tiedoista voidaan päätellä, että huolimatta siitä, että he tietävät vakaimmat rakenteet, ne eivät valaise tarpeeksi valoa tietäen siitä, kuinka molekyylien väliset voimat toimivat nesteessä; Ja vielä enemmän, näiden isomeerien kiinteässä vaiheessa.
Butenus käyttää
-Butenialaisia, kun he ovat palamislämpöä, voidaan yksinkertaisesti käyttää lämmön tai polttoaineen lähteenä. Siten odotetaan, että 1-buteenin liekki on enemmän kuin muiden isomeerien liekki.
-Niitä voidaan käyttää orgaanisina liuottimina.
-Ne toimivat lisäaineena nostamaan bensiinin oktaanitasoa.
-Orgaanisen synteesin sisällä 1-buteeni osallistuu muiden yhdisteiden tuotantoon, kuten: butyleenioksidi, 2-glutanoli, sukkinimida ja terbutilmeekaptano (käytetään keittiön kaasun tyypillisen hajun).
Myös Butene -isomeereistä voit hankkia butadienon (CHO2= Ch-ch = ch2), joista keinotekoinen kumi syntetisoidaan.
Näiden synteesin lisäksi tuotteiden monimuotoisuus riippuu siitä, mitkä molekyylit lisätään kaksoissidokseen.
Esimerkiksi alkyylihalogenidit voidaan syntetisoida, jos ne reagoivat halogeenien kanssa; alkoholit, jos ne lisäävät vettä happamassa väliaineessa; ja kolmannen butlerin, jos ne lisäävät pienen molekyylipainoisia alkoholeja (kuten metanoli).
Viitteet
- Francis a. Kilpikonnan. Orgaaninen kemia. Karboksyylihapot (kuudes painos, sivu 863-866). MC Graw Hill.
- Wikipedia (2018). Buteno. Otettu: se on.Wikipedia.org
- YPF (heinäkuu). Butenialaiset. [PDF]. Otettu: YPF.com
- William Reusch (2013). Alkejen lisäysreaktiot. Toipunut: 2.Kemia.MSU.Edu
- Pubchem (2018). 1-buteeni. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus

