Isotoninen ratkaisukomponentit, valmistelu, esimerkit
- 4864
- 246
- Gustavo Runte DVM
Eräs isotoninen ratkaisu Se esittelee saman liuenneen aineen pitoisuuden suhteessa liuokseen, joka on erotettu tai eristetty puolivälissä olevalla vikalla. Tämä este antaa liuottimen Transtelle, mutta ei kaikkia liuenneen hiukkasia.
Fysiologiassa tämä eristetty liuos viittaa solunsisäiseen nesteeseen, toisin sanoen solujen sisätilaan; Kun taas puolijaloserä vastaa solukalvoa, joka on muodostettu lipidikarjalla.
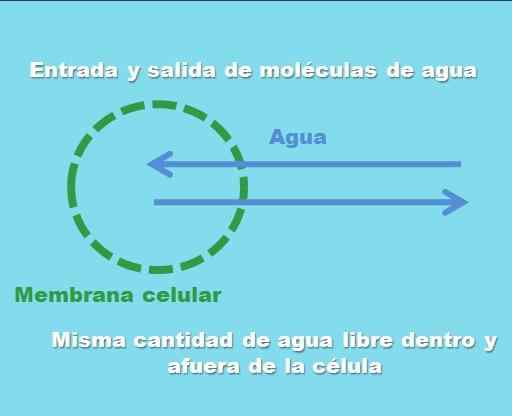
 Solun vuorovaikutus isotonisen liuoksen kanssa. Lähde: Gabriel Bolívar.
Solun vuorovaikutus isotonisen liuoksen kanssa. Lähde: Gabriel Bolívar. Ylivoimainen kuva kuvaa sitä, mitä tarkoitetaan isotonisella ratkaisulla. Veden "konsentraatio" on sama solun sisällä ja ulkopuolella, joten niiden molekyylit tulevat tai tulevat ulos solukalvon läpi, joilla on yhtä suuret taajuudet. Siksi, jos kaksi vesimolekyyliä tulee soluun, kaksi niistä lähtee samanaikaisesti kohti solunulkoista väliainetta.
Tämä tila, nimeltään isotonisuus, tapahtuu vain, kun vesipitoinen väliaine, solun sisällä ja ulkopuolella, sisältää saman määrän liuennettuja liuennettua hiukkasia. Siten liuos on isotoninen, jos sen liuenneiden aineiden pitoisuus on samanlainen kuin nesteen tai solunsisäisen väliaineen pitoisuus. Esimerkiksi 0,9% suolaliuosliuos on isotoninen.
[TOC]
Isotonisten ratkaisujen komponentit
Jotta isotoninen ratkaisu olisi, sen on ensin varmistettava, että osmoosi tapahtuu liuoksessa tai liuottimessa. Tämä on mahdollista vain, jos läsnä on puolivälissä oleva este, jonka avulla liuotinmolekyylit voivat siirtää sitä, mutta ei liuenneen aineen, erityisesti sähköisesti ladattujen liuenneiden aineiden, ioneja, ionit.
Siten liuennettua ainetta ei voida levittää konsentroituneemmilta alueilta laimennettuihin alueisiin. Sen sijaan vesimolekyylit siirtyvät paikasta toiseen, ylittäen puolivälissä olevan esteen ja tapahtuvat osmoosin. Vesipitoisissa ja biologisissa järjestelmissä tämä este on solujen huippuosaaminen solukalvo.
Voi palvella sinua: Kilpailu (biologia): Ominaisuudet, tyypit, esimerkitMolemmissa väliaineissa on myös puolivälissä oleva este ja liuotinväliaine, liuenneiden ionien tai suolojen läsnäolo on välttämätöntä: sisäinen (esteen sisällä) ja ulkoinen (esteen ulkopuolella).
Jos näiden ionien pitoisuus on sama molemmilla puolilla, vesimolekyylien ylimäärä tai alijäämää niiden ratkaisemiseksi. Toisin sanoen vesivapaiden molekyylien lukumäärä on sama, ja siksi ne eivät siirrä puolivälissä olevaa estettä missä tahansa tarkoituksena sovittaa ionien pitoisuudet sovittaa.
Valmistautuminen
- Olosuhteet ja yhtälö
Vaikka isotoninen liuos voidaan valmistaa millä tahansa liuottimella, koska vesi on solujen väliaine, tätä pidetään suosikkivaihtoehtona. Tietäen tarkalleen suolojen pitoisuuden kehon tietyssä kehossa tai verenkierrossa, on mahdollista arvioida, kuinka paljon suoloja sen on liukeneva tiettyyn tilavuuteen.
Selkärankaisten organismeissa hyväksytään, että keskimäärin liuenneiden aineiden pitoisuus veriplasmassa on noin 300 mOSM/L (miliosmolaarisuus), joka pystyy tulkitsemaan melkein 300 mmol/l. Eli se on hyvin laimennettu pitoisuus. Miliosmolaarisuuden arvioimiseksi on sovellettava seuraavaa yhtälöä:
Osmolaarisuus = M · V · G
Käytännön tarkoituksiin oletetaan g, Osmoottisen kertoimen arvo on 1. Niin, että yhtälö on nyt:
Osmolaarisuus = M · V
Missä m Se on liuenneen aineen molaarisuus ja v Hiukkasten lukumäärä, joissa mainittu liuenneaine dissosioituu veteen. Sitten kerrotaan tämän arvon 1.000 saamaan miliosmolaarisuuden tietylle liuennelle aineelle.
Voi palvella sinua: Mikä on homoplasia? (Esimerkkejä)Jos liuenneena aineella on enemmän kuin yksi, liuoksen kokonaismiliosolaarisuus on tuhansmolaarisuuksien summa jokaiselle liuennelle aineelle. Mitä enemmän liuennettua solujen sisätiloihin nähden, sitä vähemmän isotoninen on valmistettu liuos.
- Esimerkki valmistelusta
Oletetaan. Kuinka paljon punnita glukoosia? Oletetaan, että käytetään 15 grammaa NAH: ta2Poikki4.
Ensimmäinen askel
Meidän on ensin määritettävä NAH -osmolaarisuus2Poikki4 sen molaarisuuden laskeminen. Tätä varten siirrymme sen molaarimassaan tai molekyylipainoon, 120 g/mol. Koska meiltä pyydetään litraa ratkaisua, määrittelemme moolit ja meillä on suoraan molaarisuus:
Moolit (Nah2Poikki4) = 15 g ÷ 120 g/mol
= 0,125 mol
M (Nah2Poikki4) = 0,125 mol/l
Mutta kun Nah2Poikki4 Se liukenee veteen, vapauttaa napaation+ ja anioni H2Poikki4-, siten v Sen arvo on 2 osmolaarisuusyhtälössä. Jatkamme sitten Nahin laskemista2Poikki4-
Osmolaarisuus = M · V
= 0,125 mol/l · 2
= 0,25 OSM/L
Ja kertomalla se 1: llä.000 Meillä on Nahin miliosmolaarisuus2Poikki4-
0,25 OSM/L · 1.000 = 250 mOSm/l
Toinen askel
Koska liuoksen kokonaismyymälän on oltava yhtä suuri kuin 300 mosm/l, vähennämme tietääksemme, minkä glukoosin tulisi olla:
mosm/l (glukoosi) = mosm/l (yhteensä) - mosm/l (NAH2Poikki4-A
= 300 mOSm/l - 250 mOSm/l
= 50 mosm/l
Koska glukoosi ei dissosioitu, v Vale 1 ja sen osmolaarisuus ovat yhtä suuret kuin sen molaarisuus:
M (glukoosi) = 50 mosm/l ÷ 1.000
= 0,05 mol/l
Koska glukoosin molaari on 180 g/mol, määrittelemme lopulta kuinka monta grammaa meidän on punnittava sen liuottamiseksi siihen litraan isotonista liuosta:
Voi palvella sinua: Renina: rakenne, tuotanto, eritys, toiminnotMassa (glukoosi) = 0,05 mol · 180 g/mol
= 9 g
Siksi tämä Nah -isotoninen ratkaisu2Poikki4/Glukoosi valmistaa 15 grammaa Nahia2Poikki4 ja 9 grammaa glukoosia litrassa vettä.
Esimerkkejä isotonisista ratkaisuista
Isotoniset liuokset tai nesteet eivät aiheuta gradienttia tai muutoksia ionien pitoisuudessa kehossa, joten niiden toiminta keskittyy lähinnä potilailla, jotka saavat sitä verenvuodon tai kuivumisen tapauksessa.
Normaali suolaliuos
Yksi näistä liuoksista on normaali suolaliuos, 0,9 -prosenttisella NaCl -pitoisuudella.
Ringer -laktaattiliuos
Muita samaan tarkoitukseen käytettyjä isotonisia liuoksia ovat Ringer -laktaatti, joka vähentää happamuutta sen puskurin tai vaimennuskoostumuksen takia, ja Sorensenin fosfaattiliuokset, jotka koostuvat fosfaateista ja natriumkloridista.
Ei -vakituiset järjestelmät
Isotonisuutta voidaan soveltaa myös ei -vakaita järjestelmiä, kuten sellaisiin, joissa liuotin on alkoholi; Niin kauan kuin on puolivälissä oleva este, joka suosii alkoholimolekyylien läpinäkyvyyttä ja säilyttää liuenneen aineen hiukkaset.
Viitteet
- Lehr Spilvasta,. Ja muktanit, ja. (1999). Opas farmaseuttisiin erikoisuuksiin Venezuelassa. Xxxvª -painos. Globaalit versiot.
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Elsevier B.V. (2020). Isotoninen ratkaisu. Haettu: ScienEdirect.com
- Adrienne brundage. (2020). Isotoninen ratkaisu: Määritelmä ja esimerkki. Opiskelu. Toipunut: Opiskelu.com
- Felictas Merino de la Hoz. (S.F.-A. Laskimonsisäinen seroterapia. Cantabrian yliopisto. [PDF]. Palautettu: OCW.Yksikaani.On
- Lääke- ja yhdistämislaboratorio. (2020). Silmävalmisteet: isotoniset puskurit. Palautettu: Pharmlabs.Pinta -ala.Edu

