Alumiinisulfaatti (Al2 (SO4) 3)

- 2248
- 648
- Alonzo Kirlin
 Valkoinen alumiinisulfaattikiteitä
Valkoinen alumiinisulfaattikiteitä Mikä on alumiinisulfaatti?
Hän alumiinisulfaatti Se on epäorgaaninen kaava alumiinisuola2(SW4-A3, jota esiintyy yleensä valkoisena kiinteänä kiiltävänä kiteinä. Yhdisteen väriin vaikuttaa sen rautapitoisuus ja muu epäpuhtaus. Alumiinisulfaattia on kahta päätyyppiä: a ja b.
Se on erittäin liukoinen suola, ja luonnossa on harvinaista löytää se vedettömästä muodossaan. Se on yleensä hydratoitunut oktadekahydraatti -alumiinisulfaatin muodossa [2(SW4-A3.18H2Tai] tai heksadekahydraatti [2(SW4-A3.16h2JOMPIKUMPI].
Se voi myös muodostaa kaksoissuolaa kaliumin kanssa ja ammoniumin, yhdisteet, jotka tunnetaan nimellä Lights. Osittain tämä voi johtua veden affiniteetista hydraattien sisällä muiden ionien säilyttämiseksi alumiinin lisäksi.
Alumiinisulfaatin kemiallinen rakenne
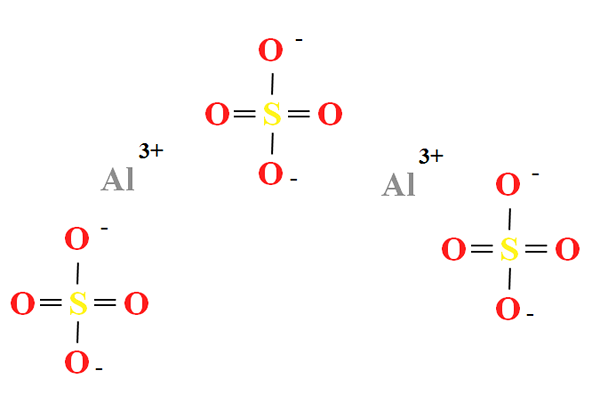 Alumiinisulfaatin kemiallinen rakenne. Lähde: Gabriel Bolívar
Alumiinisulfaatin kemiallinen rakenne. Lähde: Gabriel Bolívar Alumiinisulfaatilla on osuus kahdesta katiosta3+ jokaisesta kolmesta anionista42- (ylivoimainen kuva), joka voidaan havaita suoraan sen kemiallisessa kaavassa2(SW4-A3.
Ota huomioon, että3+ Ne ovat harmahtavia, kun taas SOS42- Ne ovat keltaisia (rikkiatomia varten) ja punaisia (happiatomeilla).
Kuvitettu rakenne vastaa AL: n vedetöntä muotoa2(SW4-A3, Koska mikään vesimolekyyli ei ole vuorovaikutuksessa ionien kanssa. Hydraateissaan vettä voidaan kuitenkin houkutella AL: n positiivisiin keskuksiin3+, tai niin42- vety silloilla (hah-o-niin32--A.
AL2(SW4-A3∙ 18H2Tai esimerkiksi se sisältää 18 vesimolekyyliä kiinteässä rakenteessaan. Jotkut heistä saattavat olla suoraan yhteydessä hänen kanssaan3+ tai SOS: n kanssa42-. Toisin sanoen: Alumiinisulfaatilla voi olla sisäinen tai ulkoinen koordinaatiovesi.
Lisäksi sen rakenne voi sijoittaa muita kationeja, kuten usko3+, Naa+, K -k -+, jne. Mutta tätä varten enemmän anionien läsnäolo on välttämätöntä42-, Metalli epäpuhtauksista johtuvien positiivisten kuormitusten lisääntymisen neutraloimiseksi.
Alumiinisulfaatilla voi olla monia rakenteita, vaikka sen hydraateilla on taipumus omaksua monokliininen kiteinen järjestelmä.
Fysikaaliset ja kemialliset ominaisuudet
Näkökohta
Se esitetään kiinteänä vilkkuvilla valkoisilla kiteillä, rakeilla tai pölyllä.
Molekyylipaino
342,31 g/mol (vedetön).
Haju
Se on wc.
Maku
Makea maku, kohtalaisen supistava.
Sulamispiste
770º C Anhydra -muoto (86,5º C oktadekahydraattimuoto).
Vesiliukoisuus
31,2 g/100 ml 0º C: ssa; 36,4 g/100 ml lämpötilassa 20º C ja 89 g/100 ml 100º C.
Tiheys
2,67 - 2,71 g/cm3.
Liukoisuus
Liukenee hieman etyylialkoholiin.
Höyrynpaine
Pohjimmiltaan nolla.
Vakaus
Ilmaa ilmassa.
Hajoaminen
Lämmitettynä, suunnilleen sulamispisteeseen, se voidaan rikkoa lähettämällä erityisesti rikkioksidia, myrkyllistä kaasua.
Syövyttävyys
Alumiinisulfaattiliuokset ovat syövyttäviä alumiinille. Myös yhdiste voi syövyttää metalleja kosteuden läsnä ollessa.
Voi palvella sinua: glukoneogeneesiPka
3,3 - 3,6. Ja sen pH on vähintään 2,9 vesiliuoksessa 5%.
Alumiinisulfaatti käyttää
Veden hyytyminen tai flokkulaatio
- Sekoitettuna veden kanssa (juomakelpoinen, tarjoiltu tai jäte), alumiinisulfaatti aiheuttaa alumiinihydroksidia, joka muodostaa kompleksin yhdisteiden ja hiukkasten kanssa liuoksessa kiihdyttämällä sen sedimentaatiota, joka alumiinisulfaatin käsittelyn puuttuessa vie myöhään pitkään.
- Alumiinisulfaattia käytetään myös uima -altaan veden puhdistamiseen, mikä tekee niistä houkuttelevampia käytettäväksi.
- Alumiinisulfaatin avulla saavutetaan vettä, jossa ei ole sameutta ja väriä, mikä lisää sen voimakkuutta helpottamalla vedenpuhdistamista. Valitettavasti tämä puhdistusmenetelmä voi johtaa hiukan lisättyyn alumiinipitoisuuteen vedessä.
- Alumiini on erittäin myrkyllinen metalli, joka kertyy ihoon, aivoihin ja keuhkoihin aiheuttaen vakavia häiriöitä. Lisäksi ei tiedetä, mikä toiminto täyttää elävissä olennoissa.
- Euroopan unioni edellyttää, että alumiinin enimmäisraja vedessä ei ylitä 0,2 mg/l. Toisaalta Yhdysvaltojen ympäristösuojeluvirasto vaatii, että veden pilaantumisraja alumiinilla ei ylitä 0,05-0,2 mg/l.
- Alumiinisulfaatin käytettyjen vesien käsittely mahdollistaa fosforin eliminoinnin tai vähentämisen, taloudellisesti.
Käytän musteen pedonaina ja paperin kehittämisessä
- Alumiinisulfaattia on käytetty väriaineiden tai musteiden petoksena, auttaen etsimään tekstiilimateriaalia. Sen kiinnitystoiminta johtuu AL: stä (OH)3, joiden gelatiinin konsistenssi tekee yhteistyötä väriaineiden adsorptiolla tekstiilien yli.
- Vaikka sitä on käytetty noin 2000.C. Kuvattuun tarkoitukseen vain orgaaniset väriaineet vaativat mordintteja. Synteettiset väriaineet toisaalta eivät vaadi mordintteja toiminnan suorittamiseksi.
- Se on siirretty paperinvalmistuksesta, mutta sitä käytetään edelleen paperimassan kehittämisessä. Poista epäpuhtaudet, samoin kuin sitä on käytetty materiaalien linkittämiseen, kuormitusten neutralointiin ja kalibrointiin.
Teollisuuskäyttö
- Sitä käytetään rakennusteollisuudessa betoniympäristön kiihdyttämiseksi. Lisäksi sitä käytetään rakenteiden vedeneristyksessä.
- Saippuat ja rasvateollisuus sitä käytetään glyseriinin tuotannossa.
- Öljyteollisuudessa heidän käyttämänsä synteettisten katalyyttien laatimiseksi heidän toiminnan aikana.
- Sitä käytetään lääketeollisuudessa supistavana lääkkeiden ja kosmetiikan valmistelussa.
- Puuttuu väriaineiden, kuten karmiinin, kehittämiseen. Sitä käytetään myös väriaineena synteettisen kumi -buttadieenin stretuksen valmistuksessa.
- Sokerinvalmistusteollisuudessa sitä käytetään sokeriruo'on melassin puhdistajana.
- Sitä käytetään deodoranttien valmistuksessa, koska se aiheuttaa hikirauhasten kanavien kaventumista, rajoittaen siten hiki -kertymistä, keinoa, joka on tarpeen bakteerien kasvulle, joka aiheuttaa huonoa hajua.
- Sitä käytetään nahkaparkunnassa, käytettäväksi tarvittava prosessi. Lisäksi sitä käytetään lannoitteiden valmistuksessa.
- Sitä käytetään lisäaineena maalausten, liimojen ja tiivisteaineiden sekä huonekalutuotteiden puhdistamisessa.
Lääke- ja terapeuttiset käytöt
- Alumiinisulfaatti on immuunijärjestelmä. Siksi se täyttää antigeenien käsittelyn toiminnan siten, että kun ne vapautetaan toimintapaikkaansa, ne tuottavat suuremman vasta -aineiden tuotannon antigeeneille, jotka ympättiin.
- Freundin ja BCG: n adjuvantti, samoin kuin muut adjuvantit, mukaan lukien endogeenit, kuten interleukiinit, eivät ole epäspesifisiä antigeeneille, mikä mahdollistaa immuunin vaikutuksen säteen lisääntymisen. Tämä on mahdollistanut rokotteiden kehittämisen lukuisia sairauksia vastaan.
- Alumiinisulfaatin koagulanttivaikutus on mahdollistanut muun muassa lukuisten virusten poistamisen käsiteltyissä vedessä, kuten beeta, MS2, T4 ja P1. Tulokset osoittavat, että veden käsittely alumiinisulfaatilla tuottaa tällaisten virusten inaktivoinnin.
- Alumiinisulfaattia käytetään tangossa tai pölynä pienten pinnallisten haavojen tai parranajojen tuottamien hankausten käsittelyssä.
- Sitä käytetään alumiiniasetaatin valmistuksessa, yhdistettä, jota käytetään joidenkin korvaolosuhteiden käsittelyssä. Sitä on käytetty myös ilman merkittävää menestystä palo -muurahaisten puremien seurausten lievittämiseksi.
- Alumiinisulfaattiliuoksia käytetään 5-10%: n pitoisuutena haavaumien paikallisessa hoidossa, jotka mahdollistavat heidän eritteidensä hallinnan.
- Alumiinisulfaatin supistava vaikutus supistuu ihon pintakerrokset, hyytyvät proteiinit ja parantavat haavat.
Muut käyttötarkoitukset
- Alumiinisulfaatti auttaa hallitsemaan liiallista levien kasvua lammikoissa, järvissä ja vesivirroissa. Sitä käytetään myös nilviäisten poistamiseen, muun muassa Espanjan etana.
- Puutarhurit levittävät tätä yhdistettä alkalisen maaperän happamiseksi. Alumiinisulfaatti hajoaa alumiinihydroksidissa ja laimennetussa rikkihapolla kosketuksessa heidän veden kanssa niiden veden kanssa. Sitten alumiinihydroksidi saostuu, jäljellä oleva rikkihappo.
- Rikkihaposta johtuvien maaperien happamoituminen visualisoidaan erittäin luovalla tavalla johtuen kasvin, nimeltään hydrangea, jonka kukat muuttuvat sinisiksi happaman maaperän läsnä ollessa; Eli ne ovat herkkiä ja reagoivat pH -muutoksiin.
- Alumiinisulfaatti puuttuu vaahdon kehittämiseen tulen torjumiseksi ja hallitsemiseksi: se reagoi natriumbikarbonaatin kanssa, mikä tuottaa CO: n vapautumisen2. Tämä kaasu estää O: n pääsyn2 materiaalin palamispaikkaan ja siten kehitetyn tulipalon lopettamiseen.
Alumiinisulfaattituotanto
Alumiinisulfaatti syntetisoidaan reagoimalla alumiiniarvikkeiden runsaasti yhdistettä, kuten bauksiittimineraali, rikkihappolla korkeissa lämpötiloissa. Seuraava kemiallinen yhtälö edustaa reaktiota:
Siihen2JOMPIKUMPI3 + H2Sw4 -Ce al2(SW4-A3 + 3 h2JOMPIKUMPI
Alumiinisulfaatti voi muodostua myös neutralointireaktiolla alumiinihydroksidin ja rikkihapon välillä seuraavan reaktion mukaan:
2 - (OH)3 + 3 h2Sw4 + 12 h2Tai ->2(SW4-A3.18H2JOMPIKUMPI
Rikkihappo reagoi alumiinin kanssa ammoniumsulfaatin muodostamiseksi ja vetymolekyylien vapautumisen kaasun muodossa. Reaktio kaavioi seuraavasti:
2 - +3 h2Sw4 -Ce al2(SW4-A3 + 3 h2
Alumiinisulfaattityypit
Alumiinisulfaatti luokitellaan kahteen tyyppiin: tyyppi A ja tyyppi B. Tyypin A alumiinisulfaatissa kiintoaineet ovat valkoisia ja niiden rautapitoisuus on alle 0,5%.
Tyypin B alumiinisulfaatissa kiintoaineet ovat ruskeita ja niiden rautapitoisuus on alle 1,5%.
On alumiinisulfaatin tuottavia toimialoja, joilla on erilaiset kriteerit luokittelulle. Siten teollisuus raportoi alumiinisulfaattityypin valmistuksesta maksimipitoisuuteen 0,1% rautaa rautaoksidina.
Kun taas tyypit B osoittavat maksimirautapitoisuuden 0,35%.
Alumiinisulfaattimyrkyllisyys
- Alumiinisulfaatti on yhdiste, joka aiheuttaa myrkyllisen vaikutuksensa kosketuksella sen pölyn kanssa, mikä aiheuttaa ihon ärsytystä ja tapauksissa, joissa kosketus on usein, ihottuma.
- Silmissä se aiheuttaa voimakasta ärsytystä, jopa aiheuttaen pysyviä vammoja.
- Sen hengitys aiheuttaa nenän ja kurkun ärsytystä, mikä voi aiheuttaa yskää ja Carrasperaa.
- Sen saanti aiheuttaa mahalaukun ärsytystä, pahoinvointia ja oksentelua.
- On myrkyllisiä vaikutuksia, jotka eivät johdu suoraan alumiinisulfaatista, ne ovat epäsuorasti niiden käyttöä varten. Tämä on alumiinin tiettyjen myrkyllisten vaikutusten tapaus, joka johtuu alumiinisulfaatin käytöstä vedenpuhdistuksessa.
- Potilaat, jotka ovat kroonisesti diakoidut puhdistetussa vedessä valmistettujen suolojen avulla alumiinisulfaatin avulla, kokevat erittäin vakavia terveyshäiriöitä. Näistä häiriöistä mainitaan anemia, dialyysidementia ja luusairauksien lisääntyminen.
Viitteet
- Wikipedia. (2018). Alumiinisulfaatti. Otettu: sisään.Wikipedia.org
- Teollisuuski. Alumiinisulfaattityyppi A ja B. Otettu: aris.com.PE -PE
- Christopher Boyd. (9. kesäkuuta 2014). Alumiinisulfaatin parhaat teollisuuskäytännöt. Otettu: Chemservice.com
- Pubchem. (2018). Alumiinisulfaatti. Otettu: Pubchem.NCBI.Nlm.NIH.Hallitus
- Kemiallinen Andesia. (20. elokuuta 2009). Alumiinisulfaattiturvallisuuslomake. [PDF]. Otettu: Andesia.com
- Kemiallinen kirja. (2017). Alumiinisulfaatti. Otettu: Chemicalbook.com

