Ammoniumsulfaatti
- 1000
- 162
- Gabriel Fahey
Selitämme, mikä on ammoniumsulfaatti, sen kemiallinen rakenne, fysikaaliset ja kemialliset ominaisuudet ja käyttää
Mikä on ammoniumsulfaatti?
Hän ammoniumsulfaatti Se on kolmiosainen ja ammoniakki epäorgaaninen rikkihapon suola. Sen kemiallinen kaava on (NH4-A2Sw4. Siksi stoikiometriset mittasuhteet sanovat, että jokaisessa sulfaatti -anionissa on kaksi ammoniumkationia, jotka ovat vuorovaikutuksessa hänen kanssaan. Tämä mahdollistaa suolan neutraalisuuden ((+1) ∙ 2 + (-2)).
Sen nimikkeistö johtuu siitä, että se on suola johdettu H: stä2Sw4, "ATO: n" "virtsarakenteen" jälkiliitteen muuttaminen. Siten kaksi alkuperäistä protonia korvataan NH: lla4+, Ammoniakin reaktion tuote (NH3-A. Joten sen synteesin kemiallinen yhtälö on: 2 NH3 + H2Sw4 => (NH4-A2Sw4
Ammoniumsulfaatti valmistetaan myös ammoniumkarbonaatin reaktiolla kalsiumsulfaatin kanssa: (NH4-A2Yhteistyö3 + Kotelo4 => (NH4-A2Sw4 + Varas3, saostaminen kalicon karbonaattia, joka on erotettu jäljellä olevasta nesteestä.
Ammoniumsulfaatti on typpi- ja rikkivarastointia, sekä välttämättömiä maaperän kemiassa ja lannoitteissa.
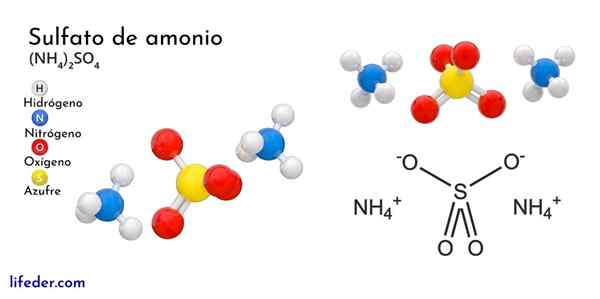
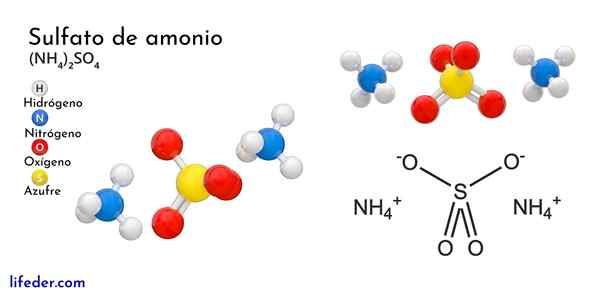
Ammoniumsulfaatin kemiallinen rakenne

Ylivoimainen kuva kuvaa NH -ionien molekyyligeometriaa4+ Ja niin42-. Punaiset pallot vastaavat happiatomeja, valkoisia vetyatomeja, sinistä typpiatomia ja keltaista rikkitomiin.
Molempia ioneja voidaan pitää kahtena tetraedrana, joten sillä on kolme yksikköä, jotka ovat vuorovaikutuksessa ortorromisen kiteisen järjestelyn muodostamiseksi. Sulfaatti -anioni on niin42- Ja se pystyy luovuttamaan tai hyväksymään neljä vety sillaa sekä NH -kationia4+.
Ammoniumsulfaattiominaisuudet
Molekyylipaino
132 134 g/mol.
Se voi palvella sinua: kemian ja tekniikan suhde ihmisen, terveyden ja ympäristön kanssaFyysinen ulkonäkö
Valkoinen kiinteä. Valkoiset tai ruskeat ortorromiset kiteet epäpuhtaustasoista riippuen.
Haju
Käymälö.
Sulamispiste
280 ºC. Tämä sulamispiste, muiden ionisten yhdisteiden alla, johtuu siitä, että se on suola, jolla on yksiarvoisia kationeja (+1), ja sen koon peittämisioneilla, aiheuttaen kiinteälle kiteiselle retikulaariselle energialle,.
Liukoisuus
76,4 g/100 g vettä 25 ° C: ssa. Tämä affiniteetti veteen johtuu niiden molekyylien suuresta kyvystä ratkaista ammoniumionien. Toisaalta se on liukenematon asetoniin ja alkoholiin; toisin sanoen vähemmän polaarisissa liuottimissa kuin vesi.
Tiheys
1,77 g/cm3 25 ºC: lla.
Höyrynpaine
1 871 kPa 20 ºC: n nopeudella.
Leimahduspiste
26 ºC.
PHE
5,0 - 6,0 (25 ºC. liuos 1 m). Hieman hapan pH johtuu NH -hydrolyysistä4+ Vedessä, tuottaa H3JOMPIKUMPI+ alhaisina pitoisuuksilla.
Vakaus
Vakaa riittävässä ympäristöolosuhteessa. Kosketuksessa vahvojen hapettimien kanssa se voi sytyttää tulen.
Hajoaminen
Se alkaa hajottaa 150 ºC: n lämpötilassa, vapauttaen myrkyllisiä rikkioksidihöyryjä, typpioksidia ja ammoniumia.
Korroosio
Ei hyökkää rautaa tai alumiinia.
Ammoniumsulfaatin käyttö
Maataloudessa
- Ammoniumsulfaattia käytetään lannoitteena alkalisessa maaperässä. Ammoniumsuola on 21 % typpi ja 24 % rikki sen koostumuksessa. On kuitenkin yhdisteitä, jotka tarjoavat määrän typpeä, joka on suurempi kuin ammoniumsulfaatti; Viimeksi mainitun etu on sen korkea rikkipitoisuus.
- Rikki on välttämätöntä proteiinisynteesissä, koska useilla aminohapolla - kuten kystiini, metioniini ja kysteiini - on rikki. Näistä syistä ammoniumsulfaatti on edelleen yksi tärkeimmistä lannoitteista.
- Sitä käytetään vehnän, maissin, riisin, puuvillan, perunan, hampun ja hedelmäpuiden viljelykasveissa.
- Mikrobien suorittamassa nitrifikaatioprosessissa alkalisen maaperän pH: n pH alhaalla. Ammoniumia käytetään (NH4+) nitraatin tuottaminen (ei3-) ja vapauta h+: 2NH4+ + Neljäs2 => 2no3- + 2H2O + 4H+. Vetypitoisuuden lisääntyminen vähentää alkalisen maaperän pH: ta ja mahdollistaa enemmän käyttöä.
- Lannoitteena käytön lisäksi ammoniumsulfaatti toimii liukoisten hyönteismyrkkyjen, rikkakasvien torjunta -aineiden ja sienitautien torjunta -aineiden adjuvanttina, jotka ruiskutetaan viljelykasveihin.
- Sulfaatti pystyy sieppaamaan ioneja maaperässä ja kasteluvedessä, jotka ovat välttämättömiä tiettyjen taudinaiheuttajien elämään. Ioneista, joiden ammoniumsulfaattikaapaukset ovat CA2+, Mg2+, usko2+ ja usko3+. Tämä vaikutus parantaa edellä mainittujen aineiden mikrobisidisiä vaikutuksia.
Analyyttisenä reagenssina
Ammoniumsulfaatti toimii saostumisaineena sähkökemiallisessa analyysissä, mikrobiologisen viljelmän keskellä ja ammoniumsuolojen valmistuksessa.
Saostumisessa ja proteiinien eristyksessä
Ammoniumsulfaattia käytetään eristys- ja proteiinien puhdistamisessa, erityisesti plasmassa. Plasmaan lisätään määrän ammoniumsulfaattia tietyn pitoisuuden ottamiseksi; Siten proteiiniryhmän saostuminen aiheutuu.
Satrifugoimalla kerätään ja supernatantti lisätään ylimääräisen määrän ammoniumsulfaattia ja uuteen konsentraatioon toisen proteiiniryhmän saostuminen tuotetaan.
Edellisen prosessin toisto mahdollistaa peräkkäin erilaisten plasmaproteiinifraktioiden saamisen.
Ennen kuin molekyylibiologian uudet tekniikat ilmestyvät, tämä menetelmä mahdollisti esimerkiksi lääketieteen erittäin tärkeän plasmaproteiinien eristyksen: immunoglobuliinit, hyytymistekijät jne.
Teollisuudessa
Ammoniumsulfaatti toimii viivästymällä tulipalon alkamista tekstiiliteollisuudessa. Sitä käytetään lisäaineena Electroanchapapado -teollisuudessa. Sitä käytetään myös vetyperoksidin, ammoniumkloridin jne.
Muut käyttötarkoitukset
- Ammoniumsulfaattia käytetään osmoottisen paineen säätelyaineena ja suolojen saostajana.
- Ammoniumsulfaattilaurilin muodossa se vähentää veden pintajännitystä, mikä mahdollistaa epäpuhtauksien erottamisen veden kovuuden lisääntymisellä.
- On antikorroosiviaine.
- Sitä käytetään elintarvikelisäaineena, joka säätelee happamuutta jauhojen taikinassa ja leivässä.
- « Missio- ja henkilökohtainen visiokonsepti, miten ne tehdään, esimerkkejä
- Myöhemmät suolat mitä ovat, nimikkeistö, ominaisuudet, esimerkit »