Mangaanisulfaatti (MNSO4) rakenne, ominaisuudet, hankkiminen, käyttö

- 3718
- 633
- Gustavo Runte DVM
Hän Mangaanisulfaatti (II) Se on epäorgaaninen kiinteä kiinteä aine, jonka muodostavat mangaanielementit (MN), rikki (S) ja happi (O). Sen kemiallinen kaava on MSO4. Sen vedettömän muoto (ilman vettä rakenteessaan) on valkoinen kiinteä aine. Siinä on kuitenkin useita hydratoituja muotoja ja ne kaikki ovat vaaleanpunaisia kiinteitä aineita.
Mangaanisulfaattia hyvin pienissä (pienissä) määrissä käytetään mikrotravinteina sekä eläimille että ihmisille, koska sitä tarvitaan organismin normaaliin toimintaan.
 Mangaanisulfaatti anhidro mnso4. YOSF0113 englanniksi Wikipedia / julkinen verkkotunnus. Lähde: Wikimedia Commons.
Mangaanisulfaatti anhidro mnso4. YOSF0113 englanniksi Wikipedia / julkinen verkkotunnus. Lähde: Wikimedia Commons. Sitä lisätään myös tiettyjen lannoitteiden kanssa mangaanin puutteellisissa maaperissä (MN) sitä tarvitseville maatalouskasveille, kuten rypälekasveille.
Hydratoitujen lajikkeiden vaaleanpunaisen värien vuoksi sitä käytetään pigmenteissä, jotka maalaavat keramiikkaa, värityskankaat ja muut materiaalit. Se myös saa muiden mangaaniyhdisteiden hankkimiseksi.
Mons4 on manipuloida huolellisesti. Sen hengitys voi aiheuttaa hengitysvaikeuksia ja aiheuttaa vakavia haittoja hermostossa, joihin sisältyy Parkinsonin tauti samanlaisia oireita.
Sen ylimääräinen voi aiheuttaa myös vaurioita maa- ja vesieläimille ja kasveille.
[TOC]
Rakenne
Vedetön mangaanisulfaatti (ilman vettä sen kiteisessä rakenteessa) muodostuu mangaani -ioni hapettumisessa +2, ts. MN2+ ja sulfaattianioni niin42-.
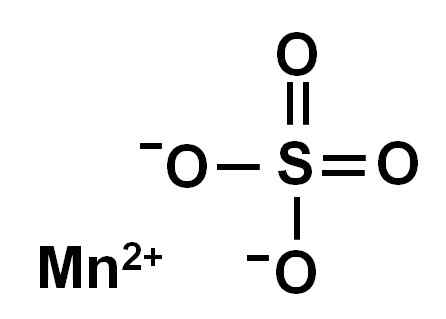 Mangaanisulfaatin kemiallinen rakenne4. Kirjoittaja: Marilú Stea.
Mangaanisulfaatin kemiallinen rakenne4. Kirjoittaja: Marilú Stea. Nimikkeistö
- Mangaanisulfaatti (II)
- Mangaanimonosulfaatti
- Mangaanisulfaatti anhidro mnso4
- Mangaanin mangaanisulfaatti MSSO4 •H2JOMPIKUMPI
- Tetrahydraatti mangaanisulfaatti MSO4 •4H2JOMPIKUMPI
- Mangaanisulfaattipentahydraatti4 •5H2JOMPIKUMPI
- Hepthydratoitu mangaanisulfaatti4 •7H2JOMPIKUMPI
Ominaisuudet
Fyysinen tila
Mons4 Vedetön (ilman vettä rakenteessaan) on kiteinen valkoinen kiinteä aine. Hydratoidut lajikkeet ovat kuitenkin vaaleanpunaisia tai vaaleanpunaisia kiinteitä aineita.
 Manganeso -sulfaattitetrahydraatti Mnso4.4H2Tai on vaaleanpunainen kiinteä. Benjah-BMM27 / julkinen verkkotunnus. Lähde: Wikimedia Commons.
Manganeso -sulfaattitetrahydraatti Mnso4.4H2Tai on vaaleanpunainen kiinteä. Benjah-BMM27 / julkinen verkkotunnus. Lähde: Wikimedia Commons. Molekyylipaino
MSSO4 = 151 g/mol
MSSO4 •H2O = 169,02 g/mol
Sulamispiste
Vedetön MSSO4 = 700 ºC
Monohydraatti MSO4 •H2O = 400-450 ° C
Menso -tetrahydraatti4 •4H2O = 30 ° C
Kiehumispiste
Vedetön MSSO4 = Se hajoaa 850 ºC: n nopeudella.
Se voi palvella sinua: kobolttikloridi (cocl2 (: rakenne, nimikkeistö, ominaisuudetMenso -tetrahydraatti4 •4H2O = 850 ° C
Tiheys
MSSO4 = 3,25 g/cm3
MSSO4 •H2O = 2,95 g/cm3
Liukoisuus
Hyvin liukoinen veteen: 52 g/100 ml vettä 5 ° C: ssa. Alkoholiliukoinen. Liukenematon eetterissä. Liukenee hieman metanoliin.
PHE
Monse -liuos4 •H2Tai 5%: n pH on 3,7.
Kemialliset ominaisuudet
Kun liukenee veteen, MNSO4 on erotettu MN -ioneiksi2+ Ja niin42-.
Mangaani -ioni (ii) mn2+ Happamassa tai neutraalissa liuoksessa se on kytketty 6 vesimolekyyliin2Tai muodostaen heksaacuomanganilaisen ionin [mn (h2JOMPIKUMPI)6-2+, mikä on vaaleanpunaista.
Heksaacuomanganilainen ioni [MN (H2JOMPIKUMPI)6-2+ Se on melko resistentti hapettumiselle. Perusväliaineessa (alkalinen pH) tästä ionista tulee mangaanihydroksidi (II) MN (OH)2, joka on helposti hapettunut, muodostaen mangaaniyhdisteitä (III) ja mangaania (IV).
 MSSO -ratkaisut4 Hapot ovat vaaleanpunaisia heksaacuomanganilaisen ionin [MN (H2JOMPIKUMPI)6-2+. Kirjoittaja: Steve Cross. Lähde: Pixabay.Mangaanisulfaatilla on useita hydratoituja muotoja, ts. Veden H kanssa2Tai kiteisessä rakenteessaan.
MSSO -ratkaisut4 Hapot ovat vaaleanpunaisia heksaacuomanganilaisen ionin [MN (H2JOMPIKUMPI)6-2+. Kirjoittaja: Steve Cross. Lähde: Pixabay.Mangaanisulfaatilla on useita hydratoituja muotoja, ts. Veden H kanssa2Tai kiteisessä rakenteessaan.
Nämä ovat monohydraatti MSO4 •H2Tai tetrahydraatti MSO4 •4H2Tai mnse pentahydraatti4 •5H2O ja hepthydraatti MSO4 •7H2JOMPIKUMPI. Nämä hydratoidut muodot sisältävät heksaacuomanganilaisen ionin [mn (h2JOMPIKUMPI)6-2+ Heidän kiteistään ja tästä syystä he ovat vaaleanpunaisia kiinteitä aineita.
Monohydraatti Menso4 •H2Tai se on hiukan ulos, mikä tarkoittaa, että se menettää osan nesteytysvedestä hitaasti, kun se altistetaan ympäristölle.
Saada
Mons4 voidaan saada käsittelemällä mangaanioksidia (II) MNO, MN Manghanous Hydroksidi (OH)2 o Mangaanikarbonaatti (II) MNCO3 Rikkihappon H2Sw4.
Mnco3 + H2Sw4 → MSSO4 + H2Tai + Co2
Sovellukset
Ravitsemuksellinen komplementti
Mangaanisulfaatti pieninä määrinä palvelee tietyiä ihmiskehon ja eläinten toimintoja.
Siksi se on tärkeä ravitsemuksen hyödyllinen yhdistelmä ja se toimitetaan elintarvikealisäosana. Sitä käytetään jälkeissä (erittäin pienet määrät).
Suuret määrät voivat olla erittäin myrkyllisiä ja haitallisia.
Eläinlääketieteessä
Mons4 Korralilinnut (kanat, kalkkunat, ankat ja faisanit) annetaan mangaanielementin puutoksen tai puuttumisen estämiseksi näissä eläimissä.
Voi palvella sinua: kaliumjodate (KIO3)Mangaanin puute ilmenee heistä, esimerkiksi sellaisena taudina, jota kutsutaan peroosiksi, joka on nuorten lintujalkojen luiden muodonmuutos.
 Patitot voivat vaatia Monste -jälkiä4 Ruokavaliossaan peroosin estämiseksi. Kirjailijat: S. Hermann & F. Rikkaus. Lähde: Pixabay.
Patitot voivat vaatia Monste -jälkiä4 Ruokavaliossaan peroosin estämiseksi. Kirjailijat: S. Hermann & F. Rikkaus. Lähde: Pixabay. Se koskee näiden lintujen ruokintaa hyvin pieninä määrinä tai jäljissä.
Maataloudessa
Mangaanisulfaattia käytetään mikrotravinteena viiniköynnöksissä (rypälekasvit) ja tupakkaistutusten puuttuvat tikkaat mangaanissa.
Jotkut tutkimukset osoittavat kuitenkin, että ylimääräinen mangaanisulfaatti voi estää tai vähentää tiettyjen tärkeiden entsyymien muodostumista kasvien kasvulle ja niiden puhkeamiselle.
 Joissakin tapauksissa se soveltaa MNSO: ta4 maahan, jossa rypälekasvit ovat. Kirjoittaja: Schwoaze. Lähde: Pixabay.
Joissakin tapauksissa se soveltaa MNSO: ta4 maahan, jossa rypälekasvit ovat. Kirjoittaja: Schwoaze. Lähde: Pixabay. Esimerkiksi on havaittu, että se on myrkyllinen joillekin kasveille, kuten puuvillaa.
Mons4 Sillä on myös käytetty sienitautien torjunta -aineissa ja yhdessä tiettyjen orgaanisten yhdisteiden kanssa on osa tiettyjä torjunta -aineita.
Useissa sovelluksissa
Mons4 Värillistä käytetään hydratoitua epäorgaanisten pigmenttien valmistamiseksi, joita käytetään punaisissa lakat keramiikassa, kankaissa ja muissa materiaalien väriaineissa.
Mangaanisulfaattia käytetään lasinvalmistuksessa, ja myös saippuat valmistetaan sen kanssa.
 Jotkut keraamiset laatat voivat sisältää mangaanisulfaattipigmenttejä. Kirjoittaja: Dwilliams. Lähde: Pixabay.
Jotkut keraamiset laatat voivat sisältää mangaanisulfaattipigmenttejä. Kirjoittaja: Dwilliams. Lähde: Pixabay. Mons4 Se on aloitusmateriaali mangaanimetalli (MN) elektrolyyttisesti, toisin sanoen levittämällä sähköä vesiliuoksiin.
Sen avulla voit myös hankkia mangaanidioksidin2 ja mangaanikarbonaatti3.
Mons4 Sitä käytetään myös kemialliseen analyysiin ja genetiikkakokeissa käytettyjen liuosten formulointiin mikro -organismien kanssa.
Riskejä
Mangaanisulfaatti sisältää mangaani -ionin (II) (MN2+), joka voi olla sekä vaarattomia että myrkyllisiä määristä riippuen, joihin henkilö, eläin tai kasvi paljastetaan.
Mangaani on välttämätön ihmisten, eläinten ja joidenkin kasvien organismin normaalille toiminnalle. Mutta valitettavasti mangaani on myös neurotoksinen, ts. Se vaikuttaa hermostoon ja joihinkin kasvien toimintoihin.
Voi palvella sinua: Kuka suunnitteli ensimmäisen modernin lämpömittarin?Näennäisesti turvalliset määrät
Mons4 Annettu elintarvikkeiden muotoisella elintarvikkeella (erittäin pienet tai pienet määrät) on yleensä turvallista elintarvikkeiden ja lääkkeiden hallinnon tai FDA: n avulla (lyhenne englanniksi Elintarvike- ja lääkehallinto-A.
Vaaralliset määrät
Pitkäaikainen tai toistuva altistuminen tälle yhdisteelle tuntuvina määrinä voi aiheuttaa haittaa ihmiselle ja eläimille.
Se tuottaa ärsytystä hengitysteiden limakalvoissa ja limakalvoissa, anoreksia, päänsärky, tasapainon menetys, keuhkokuume ja hengitystieinfektiot.
Krooninen hengitys aiheuttaa hermoston vaurioita, tuottaen manghanismia, vapina Parkinsonin taudin tyypillisissä käsissä ja oireet.
 Mangaanisulfaatti vaikuttaa hermostoon. Kirjoittaja: Sabine Zierer. Lähde: Pixabay.
Mangaanisulfaatti vaikuttaa hermostoon. Kirjoittaja: Sabine Zierer. Lähde: Pixabay. Siksi MSO -pölyn leviämistä tulisi välttää4, Käytä hengityslaitteita ja suojakäsineitä.
Se on myrkyllinen vesieliölle ja tuottaa tässä pitkät vaikutukset. Se on säilytettävä paikkoihin, joissa viemäröinti- tai viemärijärjestelmää ei ole pääsyä. On erittäin tärkeää olla sallimatta sen hylkäämistä ympäristössä.
Viitteet
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Sulfaatti -mangaani. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Ullmannin teollisuuskemian tietosanakirja. (1990). Viides painos. Volume A22. Vch verlagsgellschaft mbh.
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Mangaanisulfaattimonohydraatti. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.
- Dunham, M.J -. (2010). Opas Yast -genetiikkaan: funktionaalinen genomiikka, proteomiikka ja muut systeemianalyysit. Keskitason formulaatio. Entsymologian menetelmissä. ScienEdirect.com.
- Saric, m. ja Lucchini, R. (2007). Mangaani. Sinä käytät. Metallien toksikologian käsikirjassa (kolmas painos). ScienEdirect.com.
- Vallero, D. (2014). Ilmapolutanttien neurologiset vaikutukset. Mangaani. Ilman pilaantumisen varoissa (viides painos). ScienEdirect.com.
- Hurrata. (1986). In vitro Kulttuuri jstk Vitis: Valon spektrin mangaanisulfaatin ja kaliumjodidin vaikutukset morfogeneesiin. Kasvisolut, kudos- ja elinten kultti 7: 121-134 (1986). Linkki palautettu.Jousto.com.
- « Secbutil -rakenne, ominaisuudet, nimikkeistö, koulutus
- +125 Lyhyt ja suositut sanat [merkityksellä] »

