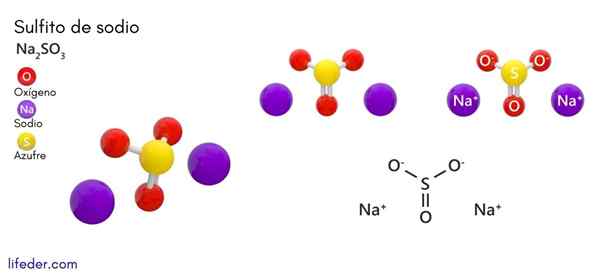
Natriumsulfiitti (Na2SO3)
- 1972
- 266
- Kelly Kilback
Mikä on natriumsulfiitti?
Hän natriumsulfiitti tai natriumsulfiitti, jonka kemiallinen kaava on NA2Sw3, Se on liukoinen natriumsuola, joka saadaan rikkihapporeaktion (tai rikkioksidin (IV)) tuotteena natriumhydroksidin kanssa.
Vuosina 1650–1660 Glauber aloitti natriumsulfiitin valmistuksen tavallisesta suolasta (NaCl) ja konsentroitua rikkihappoa. Tätä prosessia pidetään kemianteollisuuden alkua.
Sulfiittiprosessi tuottaa puulassan, jota havaitaan melkein puhtaana selluloosakuiduna käyttämällä useita rikkihapposuoloja puisten sirujen ligniinin uuttamiseksi.
Siten sulfiiteilla on suuri määrä erityyppisiä sovelluksia, myös elintarviketeollisuudessa lisäaineena. Sen merkityksellisimpien toimintojen joukossa sen entsymaattinen ja ei -entsymaattinen ruskistus, mikrobikasvun hallinta ja estäminen, oksidatiivisen juurtumisen estäminen ja elintarvikkeiden reologisten ominaisuuksien modifiointi.
Natriumsulfiitin valmistus
Yleensä laboratorioasteikolla natriumsulfiitti tapahtuu natriumhydroksidiliuoksen reaktiosta rikkidioksidikaasulla (2NAOH + SO2 → NA2Sw3 + H2JOMPIKUMPI).
Sitten niin evoluutio2 Lisäämällä muutama tippa väkevöityä suolahappoa, se osoittaa, onko natriumhydroksidi melkein puuttuva, muuttuu vesipitoiseksi natriumsulfiitiksi (NA2Sw3 + 2HCL → 2NACL + SO2 + H2JOMPIKUMPI).
Toisaalta tämä kemiallinen yhdiste saadaan teollisesti reagoimalla sulfididioksidi natriumkarbonaattiliuoksella.
Voi palvella sinua: spektrimerkinnätAlkuperäinen yhdistelmä tuottaa natriumbisulfiittiä (NAHSO3), Että reagoimalla natriumhydroksidin tai natriumkaroksidin kanssa, se muunnetaan natriumsulfiitiksi. Nämä reaktiot voidaan tiivistää globaalissa reaktiossa2 + Naa2Yhteistyö3 → NA2Sw3 + Yhteistyö2.
Kemiallinen rakenne
Kaikille natriumsulfiitin muodolle on ominaista valkoisia, kiteisiä ja hygroskooppisia kiinteitä aineita, joilla on kyky houkutella ja pitää ympäröivän ympäristön vesimolekyylejä, jotka ovat normaalisti huoneenlämpötilassa.
Kiteisen rakenteen tyyppi on kytketty veden läsnäoloon yhdisteessä. Anhydrid -natriumsulfiitti esittelee ortorromisen tai kuusikulmaisen rakenteen, ja jos yhdisteessä on vesimolekyylejä, muuttaa sen rakennetta (esimerkiksi heptahydraattiset natriumsulfiit.
Ominaisuudet
Tällä lajilla on tiettyjä fysikaalisia ja kemiallisia ominaisuuksia, jotka erottavat sen muista suoloista, jotka on kuvattu alla:
Kemialliset ominaisuudet
Kyllästetyn vesiliuoksena tämän aineen likimääräinen pH on 9. Lisäksi ilmalle altistetut liuokset hapettelevat lopulta natriumsulfaatin.
Toisaalta, jos vesiliuoksen natriumsulfiitin annetaan kiteytyä huoneenlämpötilassa tai alhaisemmassa, se tekee sen hepthydraattina. Heptahydraatit Kristallit lähtee kuumassa ja kuivassa ilmassa, ne myös hapettuu ilmassa sulfaatin muodostamiseksi.
Tässä mielessä anhydra -muoto on paljon vakaampi ilman hapettumista vastaan. Sulfiitti ei ole yhteensopiva happojen, voimakkaiden hapettimien ja korkeiden lämpötilojen kanssa. Se on myös liukenematon ammoniakkiin ja klooriin.
Voi palvella sinua: isopropyylialkoholiFyysiset ominaisuudet
Anhydrid -natriumsulfiitin molaarimassa on 126,43 g/mol, tiheys 2 633 g/cm3, Fuusiopiste 33,4 ° C (92,1 ° F tai 306,5 K), kiehumispiste 1 429 ° C (2 604 ° F tai 1 702 K), eikä se ole syttyvä. Myös liukoisuus (mitattu lämpötilassa 20 ° C) on 13,9 g/100 ml.
Käyttää/sovelluksia
Reaktiivisten ominaisuuksiensa vuoksi natriumsulfiitti on erittäin monipuolinen ja käyttää tällä hetkellä laajasti tyyppejä toimialoja.
- Sitä käytetään laajasti vedenkäsittelyssä ja liuenneen hapen eliminoinnissa vesikattiloissa.
- Sillä on myös sovelluksia paperiteollisuudessa (puoli -kid -massa).
- Valokuvassa sitä käytetään paljastavan valmistuksessa.
- Sitä käytetään asianmukaisessa määrin elintarvikkeissa ja antioksidanttien säilyttämisessä.
- Tekstiiliteollisuudessa sitä käytetään pesu- ja antiklooriprosesseissa.
- Sitä käytetään myös pelkistävänä aineena.
- Lisäksi sitä käytetään öljykaivojen sekundaarisessa talteenotossa.
- Sitä käytetään jopa orgaanisten yhdisteiden, väriaineiden, musteiden, viskoosisten rayonin ja kumien valmistuksessa.
- Sitä käytetään lukuisten kemikaalien valmistuksessa, mukaan lukien kaliumsulfaatti, natriumsulfiitti, natriumsilikaatti, natriumhyposulfiitti ja natriumalumiinisulfaatti.
Riskejä
Vaikutukset yhdisteelle altistumiseen
Pitkäaikainen tai toistuva altistuminen tälle aineelle voi aiheuttaa ihottumaa ja herkkyysreaktioita. Altistuminen sulfiittimerkissä, astmaattisessa ja atooppisessa.
Samoin natriumsulfiitin happojen hajoaminen voi vapauttaa rikkioksidien myrkyllisen ja vaarallisen savua, mukaan lukien rikkidioksidi, joka voi aiheuttaa pysyvän keuhkojen heikkenemisen kroonisesta ja akuutista altistumisesta johtuen.
Voi palvella sinua: Ididio 192Samoin akuutti myrkytys rikkidioksidilla on harvinaista, koska kaasu havaitaan helposti. Se on niin ärsyttävää, että kosketusta ei voida sietää.
Mukana on oireet, yskä, huhu, aivastelu, repiminen ja hengitysvaikeus. Työntekijät, joilla on suuri väistämätön altistuminen, voivat kuitenkin kärsiä tärkeistä ja mahdollisesti kuolevaisten keuhkovaurioista.
Ekotoksisuus
Natriumsulfiitti on ei -tahallinen liuos, jota käytetään yleisesti veden vähentymisaineena. Korkeat pitoisuudet edistävät kemiallisen hapen suurta kysyntää vesiympäristöissä.
Ruoan kulutus säilöntäaineiden kanssa
Yksi lisäaineista, jotka voivat aiheuttaa ongelmia herkillä ihmisillä2-A.
Yliherkkailla tai astmaattisissa ihmisissä, sulfiiteilla olevien elintarvikkeiden kulutus tai rikkidioksidin hengittäminen, se voi olla myrkyllistä.
Nämä yhdisteet ovat vastuussa keuhkoputkista, joka tarkoittaa hengitysvaikeuksia. Ainoa tämän liiallisen reaktion käsittely on välttää sulfiitteja sisältäviä ruokia ja juomia.