Kalsiumsulfidi (CAS) rakenne, ominaisuudet, hankkiminen, käyttö
- 624
- 32
- Shawn Stanton II
Hän Kalsiumsulfidi Se on epäorgaaninen kiinteä kiinteä aine, jonka muodostuu kalsiumin (CA) ja kemiallisen kaavan rikkielementti (rikkielementti) on CAS. Se on kellertävä valkoinen liukoinen kiinteä kiinteä kiinteä kiinteä aine, jota löytyy luonnosta joissakin tulivuorissa ja joissain meteoriiteissa mineraalin muodossa, nimeltään Oldhamite.
CAS, kun se liukenee veteen, muodostaa erilaisia yhdisteitä, koska rikki -ioni S2- tulee ion sh- ja OH -ionit muodostuvat-. Tuloksena oleva liuos on emäksinen. Tätä yhdistettä käytetään emäksenä luminesoiville yhdisteille tai se tuottaa näkyvää valoa tietyissä olosuhteissa. Näitä materiaaleja käytetään myös kevyissä maalauksissa.
 CAS -kalsiumsulfidia on löydetty joistakin meteoriiteista. Kirjailija: рраёё. Lähde: Pixabay.
CAS -kalsiumsulfidia on löydetty joistakin meteoriiteista. Kirjailija: рраёё. Lähde: Pixabay. CAS: ää on pidetty mahdollisina lääkkeinä sydänongelmien ja verisuonten, kuten verenpainetaudin tai korkean paine, hoitamiseksi, mikä on sairaus, joka vaikuttaa suureen osaan maailman väestöstä.
Kalsiumsulfidilla voidaan saada muita yhdisteitä, kuten kalsiumnitraatti ja kalsiumkarbonaatti. Sitä on käsiteltävä varoen ja kosketuksessa ilmakehän kosteuden kanssa voi tuottaa h2S, joka on erittäin myrkyllinen.
[TOC]
Rakenne
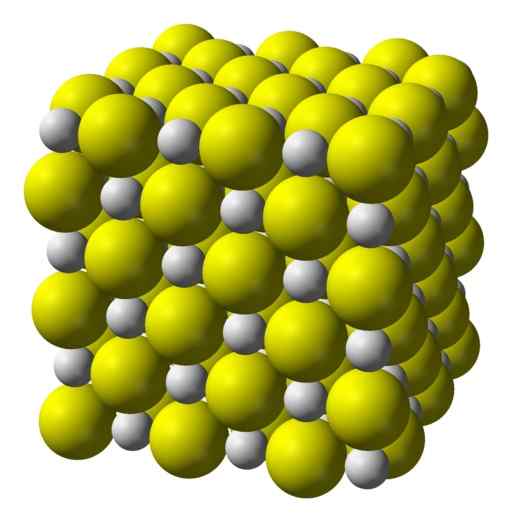
Kalsiumsulfidi on erittäin ioninen yhdiste, jonka on muodostettu CA -kalsiumionilla2+ ja sulfidi -ioni S2-.
Kiteytyy kuutiometriä, kuten kivisuola.
 Kalsiumsulfidin kuutiomettinen kiteinen rakenne. Keltainen = rikki; Valkoinen = kalsium. Benjah-BMM27 / julkinen verkkotunnus. Lähde: Wikimedia Commons.
Kalsiumsulfidin kuutiomettinen kiteinen rakenne. Keltainen = rikki; Valkoinen = kalsium. Benjah-BMM27 / julkinen verkkotunnus. Lähde: Wikimedia Commons. Nimikkeistö
- Kalsiumsulfidi
Fyysiset ominaisuudet
Fyysinen tila
Kellertävä valkoinen kiteinen kiinteä, kuutiokiteet, kuten natriumkloridi.
Molekyylipaino
72 144 g/mol
Sulamispiste
2528 ºC
Tiheys
2,59 g/cm3
Liukoisuus
Liukeneminen veteen. Liukenematon etanoliin.
Kemialliset ominaisuudet
Vesiliuos
Veteen liukeneessa CAS erotetaan sen kalsium -ioneiksi 2+ ja sulfidi2-. Jälkimmäinen vedessä vie protonin ja siitä tulee shh -hydrosulfuro -ioni- OH -hydroksyyli -ionin vapauttaminen-.
Voi palvella sinua: seulottuS2- + H2Tai ⇔ sh- + vai niin-
Siksi kalsiumsulfidiliuokset ovat emäksisiä (niillä on emäksinen pH), eikä niillä ole s -ioneja2- mutta sh-.
Vain siinä tapauksessa, että liuokseen lisätään suuri määrä alkalia, kuten NaOH -natriumhydroksidi. Tasapaino siirtyy kohti rikki -ionien muodostumista2-.
 Kalsiumsulfidi liukenee veteen muodostaen muita yhdisteitä. Kirjailija: Clker-Vector-kuvat. Lähde: Pixabay.
Kalsiumsulfidi liukenee veteen muodostaen muita yhdisteitä. Kirjailija: Clker-Vector-kuvat. Lähde: Pixabay. Sh- Voit ottaa toisen protonin H+ vettä, joka muodostaa rikkivetyä, joka on erittäin myrkyllinen yhdiste.
Sh- + H2Tai ⇔ h2S + OH-
Siksi pienet määrät H -muotoa vedessä2S ja altistumalla ympäristön kosteudelle, CAS antaa rikkivetylle tyypillisen epämiellyttävän hajun.
Yhdisteet, jotka ovat liukenevia veteen
Aikaisemmin ilmoitettujen vesireaktioiden tulos on, että CA (SH) muodostuu2, CA (OH)2 ja ca (sh) (OH).
CAS + H2O → ca (sh) (OH)
Ca (sh) (OH) + H2O → CA (OH)2 + H2S
Happoreaktio
Samat vedessä esiintyvät reaktiot saavat CAS: n reagoimaan H: n muodostavien happojen kanssa2S.
CAS + 2 HCL → CACL2 + H2S
Muut reaktiot
Jos rikin kalsiumsulfidiliuos lämmitetään, saadaan polysulfidi -ionit42- ja s32-.
Jos CAS kuumennetaan kuivassa ilmassa tai puhtaalla hapella, yhdiste hapetetaan kalsiumsulfiittiaatioon3 Ja sitten kalsiumsulfaattitapaukseen4-
2 CAS + 3 o2 → 2 tapaus3
2 tapaus3 + JOMPIKUMPI2 → 2 tapaus4
Hapettavilla aineilla, kuten kclo -kaliumkloraatti3, Kaliuminitraatti3 tai johtava dioksidi2 Väkivaltaisia reaktioita tapahtuu.
Saada
Kalsiumsulfidi voidaan valmistaa kalsifioimalla (lämmittämällä erittäin korkeassa lämpötilassa) kalsium (CA) ja rikki (S) inertissä ilmakehässä, ts. Niitä ei ole läsnä esimerkiksi happea tai vesihöyryä.
Se voi palvella sinua: kloorihappo (HCLO2)Ca + S + lämpö → CAS
Voidaan saada myös lämmittämällä kalsiumsulfaattitapausta4 Hiilen kanssa:
Kotelo4 + 2 C → CAS + 2 CO2
Viimeksi mainitussa tapauksessa puhdasta taloa ei kuitenkaan saatu, koska se reagoi lisäksi tapauksen kanssa4 muodostaen Cao ja niin2.
CAS syntyy myös polttamalla hiilijätettä.
Läsnäolo luonnossa
CAS on luonnollisesti läsnä Oldhamite -mineraalissa. Tämä on osa joitain meteoriiteja ja on tärkeä aurinkokunnan tieteellisellä tutkimuksella.
Uskotaan, että Oldhamita muodostettiin kondensaatiolla sumussa, joka on kotoisin aurinkojärjestelmästä. Sitä on myös tulivuorissa.
 CAS -kalsiumsulfid. Leon Hupperichs/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0). Lähde: Wikimedia Commons.
CAS -kalsiumsulfid. Leon Hupperichs/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0). Lähde: Wikimedia Commons. Lisäksi kalsiumsulfidi tuotetaan luonnollisesti vähentämällä tapausta4 (kipsi) mahdollisesti bakteerien vaikutuksesta.
Sovellukset
Kevyissä materiaaleissa
Yksi kalsiumsulfidin laajimmista käytöstä on ollut perusta kevyille yhdisteille. Nämä ovat aineita, jotka lähettävät näkyvää valoa tietyissä olosuhteissa.
CAS: n luminesoivissa yhdisteissä tämä toimii perustana ja aktivaattorit lisätään rakenteeseen, kuten tiettyjen elementtien kloridit, kuten CERIO (CE3+) ja Europio (EU2+-A.
CAS -liiton ja aktivaattorin aiheuttamaa materiaalia käytetään esimerkiksi katodiräteputkien näytöissä, jotka muodostavat tietokoneiden tai tietokoneiden tai vanhojen TV -laitteiden vanhat näytöt.
 Muinaisten tietokoneiden näytöillä oli katodisäteputket, joissa joskus käytetään kalsiumsulfidin ja aktivaattoreiden luminesoivia yhdisteitä. Kirjoittaja: Andreas160578. Lähde: Pixabay.
Muinaisten tietokoneiden näytöillä oli katodisäteputket, joissa joskus käytetään kalsiumsulfidin ja aktivaattoreiden luminesoivia yhdisteitä. Kirjoittaja: Andreas160578. Lähde: Pixabay. Niitä käytetään myös nykyisissä valoa säteilevien diodien tai LED -valaisimissa (lyhenne englanniksi Kevyet diodit-A.
Voi palvella sinua: Ayaroína LED-valo. Jotkut voivat sisältää kalsiumsulfidin luminesoivia yhdisteitä. Ei konetta luettavissa olevaa kirjailijaa. Apper oletettu (tekijänoikeusvaatimusten perusteella). /CC BY-SA (http: // creativecommons.Org/lisenssit/by-SA/3.0/). Lähde: Wikimedia Commons.
LED-valo. Jotkut voivat sisältää kalsiumsulfidin luminesoivia yhdisteitä. Ei konetta luettavissa olevaa kirjailijaa. Apper oletettu (tekijänoikeusvaatimusten perusteella). /CC BY-SA (http: // creativecommons.Org/lisenssit/by-SA/3.0/). Lähde: Wikimedia Commons. Näitä materiaaleja käytetään myös kevyissä maalauksissa ja lakoissa.
Lääketieteellisesti
Kalsiumsulfidia on otettu huomioon lääketieteellisissä tutkimuksissa lääkkeenä valtimoverenpaineen hoitamiseksi (korkea paine valtimoissa). Tämä on sairaus, joka vaikuttaa monien ihmisten sydän- ja verisuonijärjestelmään (sydän- ja verisuonet).
CAS: ää pidetään H: n "luovuttajana"2S. Tällä on tärkeä rooli verisuonten sävyn tai voimakkuuden säätelyssä, joten CAS -hallinto voi olla mahdollinen lääke verenpaineen hoitoon.
 Kalsiumsulfidia on tutkittu mahdollisena lääkityksenä sairaiden ihmisten sydän- ja verisuonijärjestelmän korkealle paineelle. Kirjoittaja: Mohamed Hassan. Lähde: Pixabay.
Kalsiumsulfidia on tutkittu mahdollisena lääkityksenä sairaiden ihmisten sydän- ja verisuonijärjestelmän korkealle paineelle. Kirjoittaja: Mohamed Hassan. Lähde: Pixabay. Muiden yhdisteiden saamiseksi
Kalsiumsulfidi mahdollistaa muiden yhdisteiden, kuten kalsiumnitraatin CA3-A2-
CAS + 2 HNO3 → CA (ei3-A2 + H2S
Sitä on käytetty myös Caco -kalsiumkarbonaatin saamiseksi3. Tätä varten hiilelle toimitetaan CAS -vesiliuos2-
CAS + H2Tai + Co2 → H2S + caco3
Muut sovellukset
Kalsiumsulfidia käytetään myös lisäaineena voiteluaineille ja vaahdotusaineena mineraalien uuttamisessa.
Riskejä
Kalsiumsulfidi voi aiheuttaa ihoa, silmiä ja hengitysteiden ärsytystä. On manipuloida varotoimenpiteillä ja asianmukaisilla turvallisuusvälineillä.
Se on erittäin myrkyllinen yhdiste vesielämään, joten se on vaarallinen näille ympäristöille.
Viitteet
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.
- Lyijy, d.R -. (Toimittaja). (2005). CRC: n kemian ja fysiikan käsikirja. 85th CRC -lehdistö.
- Ropp, r.C. (2013). Ryhmä 16 (O, S, SE, TE) alkaliset maapallon yhdisteet. Sulfidikalsium. Alkalisten maapallon yhdisteiden tietosanakirjassa. ScienEdirect.com.
- Li, ja.F. et al. (2009). Kalsiumsulfidi (CAS), rikkivetyen luovuttajalle (H (2) S): uusi verenpainelääke? Med -hypotees, 2009 syyskuu; 73 (3): 445-7. NCBI toipunut.Nlm.NIH.Hallitus.
- Talo J.JA. ja talo, k.-Lla. (2016). Rikki, seleeni ja telluuri. Tapahtua rikki. Kuvailevassa epäorgaanisessa kemiassa (kolmas painos). ScienEdirect.com.
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Kalsiumsulfidi. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Olut, m. et al. (2014). Kalsiumsulfidin muuntaminen kalsiumkarbonaatiksi elementtirikin palautumisprosessin aikana kipsijätteestä. Waste Manag, 2014 marraskuu; 34 (11): 2373-81. NCBI toipunut.Nlm.NIH.Hallitus.
- « Kvantitatiiviset tutkimusominaisuudet, tekniikat, esimerkit
- Kalsiumsilikaattiominaisuudet, rakenne, hankkiminen, käyttö »

