Aromaattiset nukleofiiliset substituutiovaikutukset, esimerkit
- 2559
- 808
- Joshua Emmerich
Se Aromaattinen nukleofiilinen substituutio (SNAR) on reaktio, joka tapahtuu orgaanisessa kemiassa, joka koostuu tulevan nukleofilien hyvän lähtevän ryhmän siirtymisestä. Sen mekanismin ja elektronisten näkökohtien kannalta se on aromaattisen elektrofiilisen substituution (SEAR) vastakkaiset pinta.
Yleensä lähtevä ryhmä on halogeeni, joka tulee esiin Haluro X -anionina-. Tämä reaktio voi tapahtua vain, jos aromaattinen rengas (enimmäkseen bentseeni) puuttuu elektroneihin; Eli jos sinulla on elektronien houkuttelijaryhmiä.
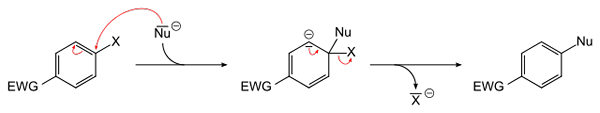
 Yleinen yhtälö aromaattiselle nukleofiiliselle substituutiolle. Lähde: Sponk [julkinen verkkotunnus]
Yleinen yhtälö aromaattiselle nukleofiiliselle substituutiolle. Lähde: Sponk [julkinen verkkotunnus] Ylivoimainen kuva kaappaa edellisessä kappaleessa sanottua. EWG Electron -houkuttelijaryhmä (lyhenne englanniksi: Elektronien vetämisryhmä), aktivoi aromaattisen renkaan negatiivisen NU -lajin nukleofiiliseen hyökkäykseen-. Voidaan nähdä, että välittäjä muodostuu (keskustassa), josta Haluro X vapautetaan tai vapautetaan-.
Huomaa, että yksinkertaisesti X -termeissä se korvataan NU: lla aromaattisessa renkaassa. Tämä reaktio on erittäin monipuolinen ja välttämätön uusien lääkkeiden synteesissä sekä synteettisen orgaanisen kemian tutkimuksissa.
[TOC]
Yleiset ominaisuudet
Aromaattinen rengas voidaan "ladata" tai "ladata" elektroneista riippuen siitä, mitkä ovat heidän substituentinsa (ne, jotka korvaavat alkuperäisen C-H-linkin).
Kun nämä substituentit voivat luovuttaa elektronista tiheyttä renkaaseen, sanotaan, että ne rikastuttavat sitä elektroneista; Jos päinvastoin he ovat houkuttelevia elektronista tiheyttä (edellä mainittu EWG), sanotaan sitten, että ne köyhdyttävät elektronirenkaan.
Joka tapauksessa rengas aktivoidaan tiettyyn aromaattiseen reaktioon, kun taas se on deaktivoitu toiselle.
Esimerkiksi aromaattisen elektronien aromaattisen renkaan sanotaan olevan aktiivinen aromaattisen elektrofiilisen substituution kannalta; Eli voit lahjoittaa elektronit elektrofilaatteihin ja+. Se ei kuitenkaan lahjoita elektroneja NU -lajeille-, Koska negatiiviset maksut hylkäsivät toisensa.
Voi palvella sinua: Molecular Orbital TheoryNyt, jos rengas on köyhä elektroneissa, sillä ei ole kuinka antaa ne lajeille ja+ (Sear ei tapahdu); Sen sijaan on saatavana hyväksyä NU -lajien elektronit- (SNAR kehittyy).
Erot aromaattisen elektrofiilisen substituution kanssa
Selvensi pääsyn yleisiä näkökohtia, joitain eroja SNAR: n ja SEAR: n välillä voidaan nyt luetella:
- Aromaattinen rengas toimii elektrofiilinä (huonot elektronit) ja nukleofiili hyökkää sitä.
- Lähtevä ryhmä X korvataan renkaasta; Ei h+
- Karbokaatioita ei muodostua, mutta välittäjät, joilla on negatiivinen varaus, joka voidaan muuttaa resonanssilla
- Renkaan houkuttelevampien ryhmien läsnäolo kiihdyttää korvaamista sen sijaan, että hidastaisi sitä
- Lopuksi, nämä ryhmät eivät käytä ohjaajia siitä, missä (missä hiilessä) korvaaminen tapahtuu. Korvaus tapahtuu aina lähtevään ryhmään X kytkettynä hiilessä.
Viimeinen kohta on esitetty myös kuvassa: C-X-linkki on rikki uuden C-NU-linkin muodostamiseksi.
Vaikutukset
Substituenttien lukumäärästä
Luonnollisesti sitä, mitä köyhempi elektroneissa on rengas, sitä nopeampi snar ja vähiten raju on olosuhteet, joita se tapahtuu. Mieti seuraavaa alemmassa kuvassa esitettyä esimerkkiä:
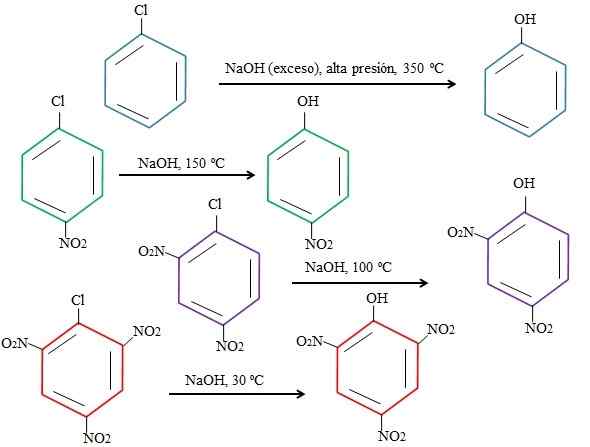 Substituenttien vaikutukset 4-nitrokloorobentseenin substituutioihin. Lähde: Gabriel Bolívar.
Substituenttien vaikutukset 4-nitrokloorobentseenin substituutioihin. Lähde: Gabriel Bolívar. Huomaa, että 4-nitrokloorobentseeni (sininen rengas) vaatii rajuja olosuhteita (korkea paine ja lämpötila 350 ºC) CL: n korvaamiseen. Tässä tapauksessa kloori on lähtevä ryhmä (CL-), ja nukleofiilihydroksidi (OH--A.
Se voi palvella sinua: 4 kemian jaksoa: esihistoriasta tähän päivään astiKun ryhmä ei ilmesty2, joka on elektronin vetovoima (vihreä rengas), korvaaminen voidaan suorittaa lämpötilassa 150 ºC ympäristön paineessa. Kun ryhmien lukumäärä kasvaa ei2 läsnä (violetti ja punainen renkaat), vaihtaminen tapahtuu yhä alhaisemmissa lämpötiloissa (vastaavasti 100 ºC ja 30ºC).
Siksi ryhmät eivät2 Ne kiihdyttävät snaria ja hyökkäyksen elektroneista renkaaseen, mikä tekee siitä alttiimman OH: n hyökkäyksen-.
CL: n suhteellisia asentoja ei selitetä tässä ei2 4-nitrokloorobentseenissä ja kuinka ne muuttavat reaktion nopeutta; Esimerkiksi 2-nitrokloorobentseenin ja 3-nitrokloorobentseenin reaktionopeudet ovat erilaisia, jälkimmäinen on hitain verrattuna muihin isomeereihin.
Lähtevän ryhmän
Palattuaan 4-nitrokloorobentseeniin, sen substituutioreaktio on hitaampi, jos vertaa fluoratun vastineen reaktiota:
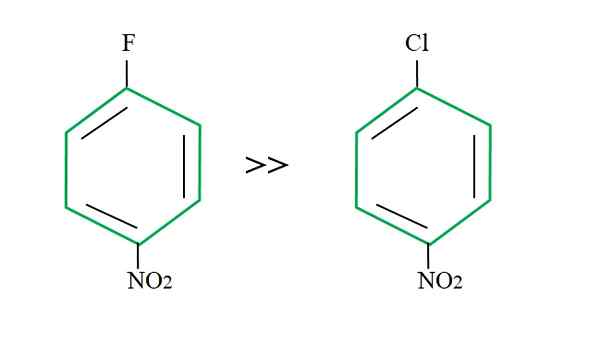 Lähtevä ryhmävaikutus snar -reaktioihin. Lähde: Gabriel Bolívar.
Lähtevä ryhmävaikutus snar -reaktioihin. Lähde: Gabriel Bolívar. Tämän selitys ei voi olla toisessa muuttujassa, että ero F: n ja Cl: n välillä. Fluori on surkea lähtevä ryhmä, koska C-F-linkki on vaikeampaa rikkoa kuin C-CL-linkki. Siksi tämän linkin hajoaminen ei ole SNAR: n nopeuden määrittävä vaihe, vaan NU: n lisääminen- aromaattiseen renkaaseen.
Fluorin elektronegatiivisempi kuin kloori, siihen liittyvä hiiliatomilla on suurempi elektroninen puute (CΔ+-FΔ--A. Näin ollen C-F-linkin hiili on paljon todennäköisemmin hyökkäävät Nu- kuin C-CL-linkki. Siksi F: n korvaaminen OH: lla on paljon nopeampaa kuin CL: n OH.
Voi palvella sinua: kuparisulfidi: rakenne, ominaisuudet, käytötEsimerkki
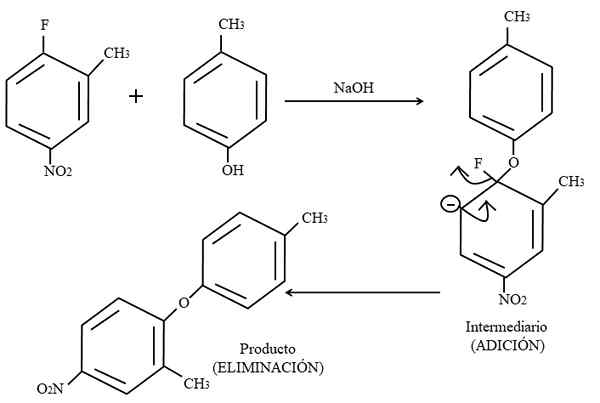 Aromaattinen elektrofiilinen korvaa. Lähde: Gabriel Bolívar.
Aromaattinen elektrofiilinen korvaa. Lähde: Gabriel Bolívar. Lopuksi, esimerkki tämän tyyppisistä orgaanisista reaktioista korkeammassa kuvassa on esitetty alla. Para-coresol ei anna ulkonäköä olla nukleofiilinä; Mutta sillä on perusväliaine, sen OH-ryhmä on suojaamaton, jättäen fenoksidianionin, joka hyökkää 2-metyyli-4-nitrofluoriiniin.
Kun tämä hyökkäys tapahtuu, sanotaan, että nukleofiili lisätään elektrofiiliin. Tämä vaihe voidaan nähdä kuvan oikealla puolella, missä välilaite, jossa molemmat renkaaseen kuuluvat substituentit, muodostuu.
Lisäämällä para-koesolia, näyttää negatiivisen kuormituksen, joka muuttaa resonanssin renkaan sisällä (huomaa, että lakkaa aromaattista).
Kuvassa viimeisin resonanssirakenne on tuskin esitetty, josta fluoridi on valmis f: ksi-; Mutta todellisuudessa tästä negatiivisesta kuormasta tulee epävarma jopa ryhmän happiatomeissa2. Eliminoinnin lisäämisen jälkeen viimeinen, joka on silloin, kun tuote lopulta muodostetaan.
Lopullinen kommentti
Ryhmä nro2 Jäljellä oleva voidaan pelkistää NH -ryhmään2, Ja sieltä on mahdollista tehdä enemmän synteesireaktioita lopullisen molekyylin modifioimiseksi. Tämä osoittaa SNAR: n synteettisen potentiaalin ja että sen mekanismi koostuu lisäksi kahdesta vaiheesta: yksi lisäys ja yksi eliminaatiosta.
Tällä hetkellä on kuitenkin kokeellista ja laskennallista näyttöä siitä, että reaktio etenee todellisuudessa koordinoidun mekanismin jälkeen, jossa molemmat vaiheet tapahtuvat samanaikaisesti aktivoidun kompleksin eikä välittäjän kautta.
Viitteet
- Morrison, r. T. ja Boyd, R, N. (1987). Orgaaninen kemia. 5. painos. Toimituksellinen Addison-Wesley Inter-American.
- Carey f. (2008). Orgaaninen kemia. (Kuudes painos). MC Graw Hill.
- Graham Solomons t.W -., Craig B. Freedle. (2011). Orgaaninen kemia. Amiini. (10. painos.-A. Wiley Plus.
- Wikipedia. (2019). Nukleofiilinen aromaattinen substituutio. Haettu: vuonna.Wikipedia.org
- James Ashenhurst. (6. syyskuuta 2019). Nukleofiilinen aromaattinen substituutio (NAS). Toipunut: MasterorganicChemistry.com
- Kemian librettexts. (5. kesäkuuta 2019). Nukleofiilinen aromaattinen substituutio. Palautettu: Chem.Librettexts.org
- « 50 suositeltavaa videopeliblogia
- Circonium -historia, ominaisuudet, rakenne, riskit, käyttötarkoitukset »

