Kvanttitaulukko
- 4198
- 182
- Alonzo Kirlin
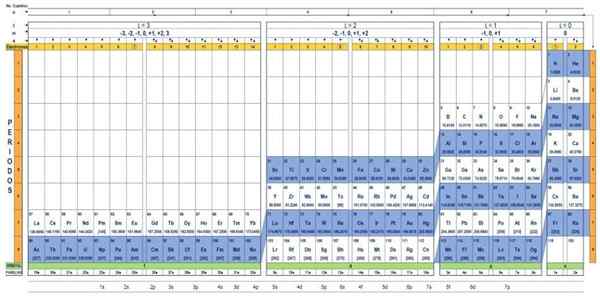
 Elementtien kvanttitaulukko. Lähde: Unam.
Elementtien kvanttitaulukko. Lähde: Unam. Mikä on kvanttitaulukko?
Se Kvanttitaulukko Se on tapa järjestää kemialliset elementit, jotka on suunniteltu helposti määrittämään kvantinumerojoukko, joka karakterisoi kutakin niistä.
Tutkijat ovat havainneet, että kaikkien elementtien luonteessa on tiettyjä malleja. Näiden kuvioiden joukossa on kvanttinumero, neljä yksinkertaista numeroa, jotka kuvaavat kunkin elementin elektronista kokoonpanoa.
Kvanttinumerot syntyvät luonnollisesti atomin mekaanisesta mekaanisesta mallista ja niitä merkitään kirjaimilla: n, ℓ, mℓ ja s. Ne kuvaavat elektronien energiatilaa kunkin kemiallisen elementin atomiin.
Perinteisen jaksollisen taulukon ja joidenkin lisätyökalujen kautta on mahdollista saada minkä tahansa elementin atomin elektroninen kokoonpano. Kvanttitaulukon etuna on, että elementit on järjestetty siten, että niiden kvantinumerot ovat heti näkyvissä ilman tarvetta tehdä lukuisia laskelmia erikseen.
Kvanttitaulukon ominaisuudet
Kvanttitaulukoissa on useita. Yllä olevassa kuvassa esitetty malli sisältää:
- Otsikko, jossa on neljä riviä, joissa on neljä kvantinumeroa, n, ℓ, m ja s, sekä viidennen rivin keltainen, mikä vastaa elektronien lukumäärää uloimmassa kiertoradalla.
- Taulukon runko, joka koostuu ruudukosta, joka sisältää kemiallisen elementin symbolin, joka alkaa vedystä, oikean viimeisen pylvään, jota seuraa helium ja niin edelleen. Alla oleva luku edustaa atomielektronien määrää perustilassa.
- Alareunassa vihreässä rivissä on neljä luokkaa elementtien järjestämiseksi: Orbitaalit S, P, D ja F (vasemmalta oikealle).
- Lopuksi, kiertoradan alla on perhe. Jokainen sarake on perhe, numeroitu välillä 1 - 32. Esimerkiksi 1. ja 2. perhe.
Mikä on kvanttitaulukko?
Kvanttitaulukon on löydettävä kvanttilukujoukko, joka karakterisoi elektronia atomista. Normaalisti nämä elektronit ovat uloimman kerroksen, koska ne määrittelevät elementin kemiallisen käyttäytymisen.
Kuinka kvanttitaulukko on?
Kvanttitaulukko mahdollistaa elektronien kvantinumero helposti atomin uloimmasta kerroksesta.
Esimerkki 1
Menettelyn havainnollistamiseksi alumiinielementti otetaan esimerkkinä, jonka symboli on. Ensimmäinen askel on löytää se kvanttitaulukosta, merkitsemällä se a Punainen ympyrä-
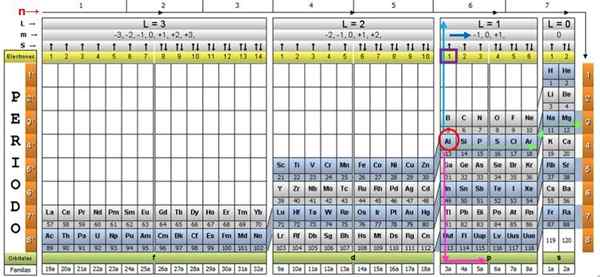
Vaihe 1: Löydä n
Kun olet löytänyt elementin taulukosta, sinun on siirryttävä saman rivin ja värin läpi oikealle, kunnes saavut oranssille pylvääseen, kuvan osoittaman vihreän nuolen tien jälkeen.
Nuoli osoittaa merkittyyn laatikkoon numerolla 3, joka on pääkvantinumero n:
n = 3
Vaihe 2: Löydä ℓ
Toissijaisen kvantinumeron määrittämiseksi noudatetaan sinistä pystysuuntaista nuolta, mikä osoittaa:
ℓ = 1.
Vaihe 3: Löydä m
Ulkoinen alumiinielektroni löytyy Pubilling P -perheestä, kuten voidaan lukea vihreällä rivillä, joihin vaaleanpunaiset nuolet pisteet.
Lisäksi viimeisessä kerroksessa olevien elektronien määrä luetaan otsikon keltaisessa rivissä. Alumiinin tapauksessa on 1 elektronia (korostettu violetissa neliössä), mikä on viite. Yllä olevien tulosten yhdistäminen viimeisen kerroksen kokoonpano on:
Voi palvella sinua: Galvaaninen solu: Osat, miten toimii, sovellukset, esimerkit3P1
On tiedossa, että P -kerros tukee korkeintaan 6 elektronia. Ja numero M vie osan kokonaisista arvoista - ℓ, ( - ℓ+1),… 0,… (+ℓ −1),+ℓ.
Kuten tässä tapauksessa ℓ = 1, niin M voi olla −1, 0, 1.
Nämä numerot näkyvät otsikon rivillä, jotka vastaavat m: tä (katso kuvassa Vaakasuora nuoli sininen). Seuraava taulukko toimii oppaana tietää, mikä on valinnan arvo tapauksesta riippuen:
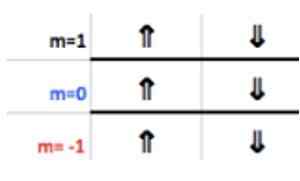
Koska viimeisellä alumiinikerroksella on 1 elektroni, magneettinen kvanttiluku vastaa
M = 1.
Vaihe 4: Löydä s
Spin -numerolla S on vain kaksi arvoa: +½ tai - ½. Ylälaatikossa, jos nuoli osoittaa, se valitaan s = +½ ja jos se osoittaa, niin S = - ½. Alumiinin tapauksessa elektroni 1 pistettä ylöspäin:
S = + ½.
Lyhyesti sanottuna, äänen uloimman alumiinikerroksen elektronin kvantinumerot:
n = 3; ℓ = 1; M = 1, s = +½
Esimerkki 2 (poikkeukselliset tapaukset)
Hopea AG ja noin kaksikymmentä muuta elementtiä ovat poikkeuksellisia tapauksia, joten kvanttitaulukkoa käytettäessä on varovainen.
Jos edellinen menettely toistetaan, AG saadaan viimeisenä alatasolla 4D: ssä9.
Tämä johtuu siitä, että Madelungin säännön mukaan ennustettu La Plata -konfiguraatio on:
1s2 2s2 2 p6 3s2 3P6 4S2 3D10 4P6 5s2 4D9
Käytännössä AG ei kuitenkaan noudata tätä kokoonpanoa tarkalleen, eikä mitään muita elementtejä, joiden viimeinen ennustettu kerros on 4D9, kuten kupari ja kulta, muun muassa (kysy Internetiä saadaksesi täydellinen luettelo elementeistä, jotka eivät noudata Madelungin sääntöä).
Voi palvella sinua: molealiteettiAG: n todellinen kokoonpano on:
1s2 2s2 2 p6 3s2 3P6 4S2 3D10 4P6 5s1 4D10
Jossa 5S -kerroksen elektroni2 Hyppäsi 4D -kerrokseen9 Suorita se. Tällä tavoin atomin vakaus kasvaa. Siksi viimeinen ala -taso todella on:
5s1
Ja sen kvantinumerot olisivat rb -elementtiä, jotka on esitetty violetissa laatikossa, oransseilla nuolilla, jotka osoittavat jäljellä oleviin numeroihin:
n = 5; ℓ = 0; M = 0; S = +½
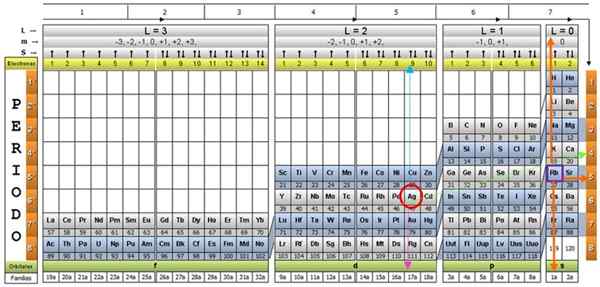 Määräaikaisen taulukon tarkistaminen, käytännössä nähdään, että AG on ajanjaksolla 5, ominaisuus, joka määritetään pääkvanttiluku N.
Määräaikaisen taulukon tarkistaminen, käytännössä nähdään, että AG on ajanjaksolla 5, ominaisuus, joka määritetään pääkvanttiluku N.
Erot jaksollisen taulukon kanssa
Molemmat taulukot ovat kaksi tapaa järjestää kemialliset elementit niiden atomien ominaisuuksien mukaan:
-Jaksollisessa taulukossa samasta pylväästä löydetyillä elementeillä on samanlaiset kemialliset ominaisuudet. Esimerkiksi, se alkaa vasemmalla olevalla alkalimetallikolonnilla ja päättyy jalokaasujen oikealle. Kun taas riveissä ovat elementit, joilla on sama korkeampi energiataso.
-Kvanttitaulukossa on askel, joka on suunniteltu täyttösääntöjen mukaisesti. Siksi sinun on noudatettava vaiheita saadaksesi pääkvantinumero, lukuun ottamatta poikkeuksia, kuten hopeaa, edellisen osan esimerkissä. Tämän taulukon elementtien perheet liittyvät ylemmän kiertoradan kautta S, P, D tai F.
Viitteet
- Chang, R. 2013. Kemia. 11Va. Painos. McGraw Hill -koulutus.
- Elektroninen kokoonpano. Elektroninen kokoonpano ja kvanttinumerot. Haettu osoitteesta: configUionektronica.com.
- Kemian käsikirja. Haettu: DCB.tekniikka.Yksinäinen.MX.
- Virallinen kemia. Kuinka helpottaa kvantinumeroita helpoksi. Haettu: Kemian virkamies.com
- Kolminkertainen. Poikkeuksia Madelungin säännöstä kemiallisten elementtien elektronisessa kokoonpanossa. Haettu: Triplenlace.com.

