Molekyylisen kineettisen teorian historia, postulaatit ja esimerkit

- 1721
- 245
- Shawn Stanton II
Se Molekyylien kineettinen teoria Se pyrkii selittämään kaasujen kokeelliset havainnot mikroskooppisesta näkökulmasta. Toisin sanoen se yrittää yhdistää kaasumaisten hiukkasten luonteen ja käyttäytymisen nesteenä kaasun fysikaalisiin ominaisuuksiin; Selitä makroskooppinen mikroskooppisesta.
Kaasut ovat aina olleet tutkijoiden kiinnostava kohde niiden ominaisuuksien takia. He miehittävät koko säiliön tilavuuden, jossa he ovat, ja kykenevät puristamaan kokonaan ilman sisältöä vastustaen alempaa vastustusta; Ja jos lämpötila nousee, säiliö alkaa laajentua ja voi jopa halkeaa.
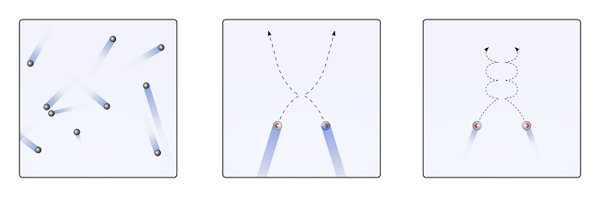 Kaasumaiset hiukkaset kaukaisissa olosuhteissa tai lähellä nesteyttämistä. Lähde: Olivier Cleynen ja käyttäjä: Sharayanan [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Kaasumaiset hiukkaset kaukaisissa olosuhteissa tai lähellä nesteyttämistä. Lähde: Olivier Cleynen ja käyttäjä: Sharayanan [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Monet näistä ominaisuuksista ja käyttäytymisistä on esitetty yhteenveto ihanteellisten kaasujen laeissa. He kuitenkin pitävät kaasua kokonaisuutena eikä miljoonia dispergoituneita hiukkasia avaruudessa; Lisäksi se ei tarjoa paineen, tilavuuden ja lämpötilatietojen perusteella lisätietoja siitä, kuinka nämä hiukkaset liikkuvat.
Silloin se on, että molekyylikineettinen teoria (TCM) ehdottaa niiden visualisoimista liikkuvina palloilla (ylivoimainen kuva). Nämä pallot törmäävät toisiinsa ja seinät mielivaltaisesti ja ylläpitävät lineaarista etenemissuuntausta. Kuitenkin, kun lämpötila laskee ja paine nousee, pallojen etenemissuunta muuttuu käyräksi.
TCM: n mukaan kaasun on käytettävä kuin ensimmäisen kuvalaatikon pallot. Mutta jäähdytettäessä ja lisäämällä painostusta heidän käyttäytymisensä siirtyy pois ihanteesta. Ne ovat sitten todellisia kaasuja, lähellä nesteyttämistä ja menevät nestefaasiin.
Näissä olosuhteissa pallojen väliset vuorovaikutukset muuttuvat tärkeämmäksi siihen pisteeseen, että niiden nopeudet ovat hetkeksi hitaasti. Mitä lähempänä he ovat nesteyttämisestä, sitä enemmän käyriä heidän etenemissuunnastaan (oikea laatikko) tulee, ja heidän törmäykset ovat vähemmän energiaa.
[TOC]
Historia
Daniel Bernoulli
Rooman filosofi Lucretius oli jo harkinnut ajatusta näistä alueista, joita kutsutaan paremmin atomeiksi; Ei kaasuille, vaan kiinteille, staattisille esineille. Toisaalta, vuonna 1738 Daniel Bernoulli sovelsi atomivisio kaasuihin ja nesteisiin kuvittelemalla ne epäjärjestyksellisinä palloina, jotka liikkuvat kaikkiin suuntiin.
Hänen työnsä kuitenkin loukkasi fysiikan lakeja tuolloin; Keho ei voinut liikkua ikuisesti, joten oli mahdotonta ajatella, että joukko atomeja ja molekyylejä törmäsi keskenään menettämättä energiaa; toisin sanoen joustavien törmäysten olemassaolo ei ollut mahdollista.
Rudolf Clausius
Vuosisataa myöhemmin muut kirjoittajat vahvistivat TCM: tä mallilla, jossa kaasumaiset hiukkaset liikkuivat yhteen suuntaan. Rudolf Clausius kuitenkin kokosi tuloksensa ja asetti täydellisemmän mallin TCM: stä, jonka kanssa se pyrki selittämään Boyle, Charles, Dalton ja Avogadro osoittavat ihanteelliset kaasulat.
Voi palvella sinua: Coulombimetria: Perusteet, tyypit, sovelluksetJames Clerk Maxwell ja Ludwig Boltzmann
Vuonna 1859 James Clerk Maxwell totesi, että kaasumaisilla hiukkasilla on nopeusalue tietyssä lämpötilassa ja että joukko niitä voidaan harkita keskimääräisen molekyylin nopeuden avulla.
Sitten vuonna 1871 Ludwig Boltzmann yhdisti olemassa olevat ideat entropiaan, ja kuinka termodynaamisesti yleensä pyrkii miehittämään mahdollisen mahdollisen tilan homogeenisella ja spontaanilla tavalla.
Posulatulaatio molekyylikineettinen teoria
Hiukkasten kaasun pohtimiseksi malli, jossa tiettyjä postulaatioita tai oletuksia täyttyy; Postuloi, että loogisesti pitäisi pystyä ennustamaan ja selittämään (mahdollisimman uskollisia) makroskooppisia ja kokeellisia havaintoja. TCM: n postulaatit mainitaan ja kuvataan.
Kaasumaisten hiukkasten tilavuus on vähäinen
Kaasumaisten hiukkasten täynnä olevassa säiliössä ne leviävät ja liikkuvat niiden väliin kaikkien kulmien läpi. Jos he kaikki voisivat tavata astian tietyssä pisteessä ilman nesteyttämistä, havaitaan, että he tuskin miehittävät halveksittavan osan säiliön tilavuudesta.
Se tarkoittaa, että säiliössä, vaikka se sisältää miljoonia kaasumaisia hiukkasia, se on todella tyhjempi kuin täysi (tilavuus-vacío-suhde paljon vähemmän kuin 1); Siksi, jos hänen esteet sallivat sen, hän ja kaasu sisäpuolella voidaan puristaa äkillisesti; Koska hiukkaset ovat hyvin pieniä, aivan kuten niiden tilavuus.
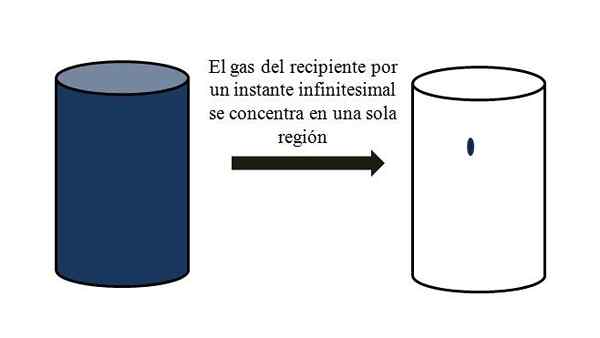 Kaasun tilavuus-vacío-suhde säiliössä. Lähde: Gabriel Bolívar.
Kaasun tilavuus-vacío-suhde säiliössä. Lähde: Gabriel Bolívar. Ylivoimainen kuva kuvaa tarkasti, mitä edellä kommentoidaan, sinertävän kaasun avulla.
Hiukkasten väliset vetovoimat ovat tyhjiä
Kontin sisällä kaasumaiset hiukkaset törmäävät keskenään ilman riittävää aikaa niiden vuorovaikutuksen voimaan; Vielä vähemmän, kun se, mikä pääasiassa ympäröi niitä, on molekyyli tyhjä. Välitön seuraus tästä on, että niiden lineaariset suuntaukset antavat heille mahdollisuuden peittää kontin tilavuus kokonaan.
Jos yllä olevat eivät olisi niin, "omituisella" ja "labyrinttisellä" säiliöllä olisi märät alueet kaasun kondensaation seurauksena; Sen sijaan hiukkaset kulkevat koko astian täydellä vapaudella ilman vuorovaikutuksensa vahvuutta.
Voi palvella sinua: kloorihappo (HCLO3) Kaasumaisten hiukkasten hävittäminen, kun vuorovaikutukset ovat tyhjiä tai merkityksettömiä (., lineaarinen), ja kun ne ovat tärkeitä (b., käyrät). Lähde: Gabriel Bolívar.
Kaasumaisten hiukkasten hävittäminen, kun vuorovaikutukset ovat tyhjiä tai merkityksettömiä (., lineaarinen), ja kun ne ovat tärkeitä (b., käyrät). Lähde: Gabriel Bolívar. Yläkuvan lineaariset etenemiset (a.) osoittaa tämä postulaatti; Kun taas etenemiset ovat käyriä (b.), todisteita siitä, että on vuorovaikutuksia, joita ei voida sivuuttaa hiukkasten keskuudessa.
Kaasumaiset hiukkaset ovat aina liikkeessä
Kahden ensimmäisen postulaatin jälkeen lähentyvät lisäksi sitä, että kaasuhiukkaset eivät koskaan lopeta liikkumista. Kun se on hämärtynyt astiassa, ne törmäävät toisiinsa ja saman seinämien kanssa voimalla ja nopeudella, joka on suoraan verrannollinen absoluuttiseen lämpötilaan; Tämä voima on paine.
Jos kaasumaiset hiukkaset lopettavat liikkumisen hetken, se olisi todistamassa "savukielten" sisällä, joka ei johdu tyhjästä, riittävästi aikaa tilata itsensä tyhjiössä ja antaa satunnaisia tapoja.
Hiukkasten ja säiliön seinien väliset törmäykset ovat joustavia
Jos kaasumaisten hiukkasten ja säiliön seinämien väliset elastiset törmäykset eivät koskaan tapahdu säiliössä, sitä ei koskaan tapahdu (vaikka fysikaaliset olosuhteet eivät muutu) kaasun tiivistymistä; tai mikä on sama kuin sanoa, että he eivät koskaan lepää ja he törmäävät aina.
Tämä johtuu siitä, että joustavissa törmäyksissä ei ole nettomenetystä kineettistä energiaa; Hiukkas törmää seinän kanssa ja pomppii samalla nopeudella. Jos hiukkas, kun törmäys pienenee, muut kiihtyy ilman lämpöä tai ääntä, joka hajottaa minkä tahansa niistä kineettisen energian.
Kineettinen energia ei pysy vakiona
Hiukkasten liike on satunnainen ja kaoottinen, joten kaikilla ei ole samaa nopeutta; kuten tapahtuu, esimerkiksi moottoritiellä tai väkijoukolla. Jotkut ovat energisempiä ja kulkevat enemmän nopeutta, kun taas toiset ovat hitaita, odottaen törmäyksen kiihdyttämistä.
Nopeuden kuvaamiseksi on sitten tarpeen laskea keskimäärin; Ja tällä saadaan hiukkasten tai kaasumolekyylien keskimääräinen kineettinen energia. Kun kaikkien hiukkasten kineettinen energia muuttuu jatkuvasti, keskiarvo mahdollistaa paremman tiedonhallinnan ja voit työskennellä paremmin luotettavuudella.
Keskimääräinen kineettinen energia on yhtä suuri kuin tietty lämpötila kaikille kaasuille
Keskimääräinen molekyylikineettinen energia (ECKansanedustaja) Säiliössä sitä muokataan lämpötilan kanssa. Korkeammassa lämpötilassa tämä energia on suurempi. Koska se on keskimäärin, voi olla hiukkasia tai sooda, joilla on suurempi tai pienempi energiaa tämän arvon suhteen; Jotkut nopeammin ja hitaampia, vastaavasti.
Voi palvella sinua: hapot ja emäkset: erot, ominaisuudet, esimerkitMatemaattisesti voidaan osoittaa, että ECKansanedustaja Se riippuu yksinomaan lämpötilasta. Tämä tarkoittaa, että sillä ei ole väliä, mikä kaasu, sen molekyylimassa tai rakenne, sen ECKansanedustaja Se on sama t -lämpötilassa ja vaihtelee vain, jos se kasvaa tai vähenee. Kaikista postulaateista ehkä tämä on merkityksellisin.
Entä keskimääräinen molekyylinopeus? Toisin kuin ECKansanedustaja, Molekyylimassa vaikuttaa nopeuteen. Hiukkas- tai kaasumolekyyli raskaampi on luonnollista odottaa liikkuvan hitaammin.
Esimerkit
Alla on joitain lyhyitä esimerkkejä siitä, kuinka TCM on onnistunut antamaan selityksiä ihanteellisten kaasujen lakeille. Vaikka niitä ei käsitellä, muut ilmiöt, kuten kaasujen leviäminen ja effuusio, voidaan selittää myös TCM: llä.
Boyle -laki
Jos säiliön tilavuus puristetaan vakiolämpötilassa, etäisyys, jonka kaasumaisten hiukkasten on törmättävä, törmääkseen seiniin vähenee; mikä on yhtä suuri kuin näiden törmäysten taajuuden lisääntyminen, mikä johtaa suurempaan paineeseen. Kun lämpötila on vakio, ECKansanedustaja Se on myös vakio.
Charles Law
Jos t, EC kasvaaKansanedustaja kasvaa. Kaasumaiset hiukkaset liikkuvat nopeammin ja törmäävät enemmän kertoja säiliön seinien kanssa; lisää painetta.
Jos seinät ovat joustavia, kykenevät laajentumaan, sen pinta -ala kasvaa ja paine laskee, kunnes se tulee vakiona; Ja seurauksena myös tilavuus kasvaa.
Daltonin laki
Jos tilavaan astiaan lisättäisiin useita litroita erilaisia kaasuja, pienemmistä astioista, niiden sisäinen paine olisi yhtä suuri kuin kunkin kaasutyypin käyttämien osittaisten paineiden summa erikseen.
Koska? Koska kaikki kaasut alkavat törmätä toisiinsa ja hajottaa homogeenisesti; Niiden väliset vuorovaikutukset ovat tyhjiä, ja tyhjiö hallitsee säiliössä (TCM: n postulaatit), joten se on kuin jokainen kaasu löytyy yksin, painostaen yksilöllisesti ilman muiden kaasujen häiriöitä.
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage Learning, s. 426-431.
- Fernández Pablo. (2019). Molekyylien kineettinen teoria. Viikulata. Palautettu: VIX.com
- Jones, Andrew Zimmerman. (7. helmikuuta 2019). Kaasujen kineettinen molekyyliteoria. Toipunut: Admingco.com
- Hall Nancy. (5. toukokuuta 2015). Kaasujen kineettinen teoria. Glenn Research Center. Haettu: GRC.potti.Hallitus
- Blaber m. & Lower S. (9. lokakuuta 2018). Kineettisen molekyyliteorian perusteet. Kemian librettexts. Palautettu: Chem.Librettexts.org
- Kineettinen molekyyliteoria. Haettu: Chemed.Kemia.Purduke.Edu
- Wikipedia. (2019). Kaasujen kineettinen teoria. Haettu: vuonna.Wikipedia.org
- Toppr. (S.F.-A. Kaasujen kineettinen molekyyliteoria. Toipunut: Toppr.com

