Termokemia

- 2316
- 431
- Gabriel Fahey
Selitämme, että se on lämpökemia, mitä tutkimuksia, sen lakeja ja sovelluksia
 Thermokemiassa lämpömuutoksia tutkitaan kemiallisissa reaktioissa
Thermokemiassa lämpömuutoksia tutkitaan kemiallisissa reaktioissa Mikä on lämpökemia?
Se Termokemia Se on vastuussa lämpömuutosten tutkimisesta, jotka suoritetaan kahden tai useamman kemiallisen lajin välisissä reaktioissa. Sitä pidetään olennaisena osana termodynamiikkaa, joka tutkii lämmön ja muun tyyppisiä energiatyyppejä, jotta voidaan ymmärtää suunta, johon prosessit kehitetään ja miten sen energia vaihtelee.
On myös välttämätöntä ymmärtää, että lämpö sisältää kahden kappaleen välillä tapahtuvan lämpöenergian siirron, kun nämä ovat eri lämpötiloissa; Kun taas lämpöenergia liittyy satunnaiseen liikkeeseen, jolla atomilla ja molekyyleillä on.
Siksi, koska melkein kaikki kemialliset reaktiot, energia imeytyy tai vapautuu lämmön kautta, termokemian kautta tapahtuvien ilmiöiden analyysi on erittäin merkityksellinen.
Mitä tutkitaan lämpökemia?
Thermokemiassa tutkitaan lämpömuutoksia lämmön muodossa, joka tapahtuu kemiallisissa reaktioissa tai kun fysikaalisia muunnoksia tarkoittavia prosesseja.
Tässä mielessä tietyt käsitteet on selvennettävä aiheesta.
Järjestelmä
Esimerkiksi termi "järjestelmä" viittaa tutkittavan maailmankaikkeuden erityiseen segmenttiin, ja sitä ymmärretään "maailmankaikkeuteen" järjestelmän ja sen ympäristön huomioimiseksi (kaikki tämän ulkopuolelle).
Joten järjestelmä koostuu yleensä lajeista, jotka osallistuvat kemiallisiin tai fysikaalisiin muutoksiin, joita esiintyy reaktioissa. Nämä järjestelmät voidaan luokitella kolmeen tyyppiin: avoin, suljettu ja eristetty:
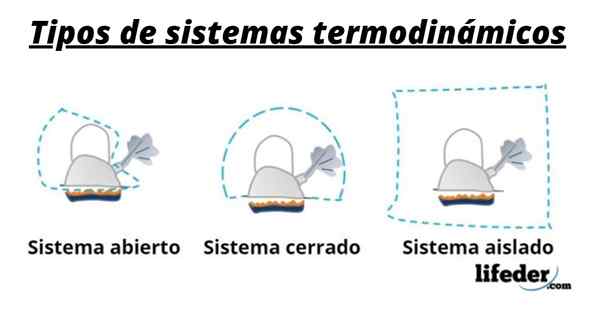
- Avoin järjestelmä on sellainen, joka mahdollistaa aineen ja energian (lämmön) siirron ympäristön kanssa.
- Suljetussa järjestelmässä on energianvaihtoa, mutta ei asiaa.
- Eristetyssä järjestelmässä aineen tai energian siirtoa lämmön muodossa ei esitetä. Nämä järjestelmät tunnetaan myös nimellä "adiabaattinen".
Termokemialaki
 Germain Hess, Hessin lain luoja, olennainen termokemiaan
Germain Hess, Hessin lain luoja, olennainen termokemiaan Termokemian lait liittyvät läheisesti Laplacen ja Lavoisierin lakiin sekä Hessin lakiin, jotka ovat termodynamiikan ensimmäisen lain edeltäjät.
Ranskan Antoine Lavoisierin (tärkeä kemiallinen ja jalo) ja Pierre-Simon Laplace (kuuluisa matemaatikko, fysikaalinen ja tähtitieteilijä) asettama periaate arvioi, että ”fysikaalisessa tai kemiallisessa muutoksessa tapahtuvan energian muutoksella on sama ja tarkoituksenmukainen suuruus päinvastainen käänteisen reaktion energian muutos ".
Hess -laki
 Yksinkertainen ja yleinen kaavio, jossa sovelletaan neljän kemiallisen reaktion hess -lakia
Yksinkertainen ja yleinen kaavio, jossa sovelletaan neljän kemiallisen reaktion hess -lakia Samassa ideajärjestyksessä Sveitsin venäläisen kemian laatiman laki Germain Hess on kulmakivi termokemian selittämiselle.
Tämä periaate perustuu sen tulkintaan energiansäästölakiin, joka viittaa siihen, että energiaa ei voida luoda tai tuhota, vain muuttunut.
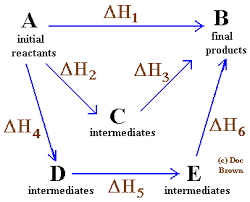
Hessin laki voidaan julistaa tällä tavalla: "Kemiallisen reaktion kokonainen entalpia on sama, onko reaktio suoritetaan yhdessä vaiheessa ikään kuin se tapahtuu useiden vaiheiden sarjassa".
Koko entalpia tapahtuu tuotteiden entalpian summan välisenä vähennyksenä paitsi reagenssien entalpian summan välillä.
Järjestelmän tavanomaisessa entalpian muutoksessa (tavanomaisissa olosuhteissa 25 ° C ja 1 atm), se voidaan kaavioida seuraavan reaktion mukaan:
Voi palvella sinua: klorogeenihappoΔHreaktio = Σδh(Tuotteet) - Σδh(reagenssit)
Toinen tapa selittää tämä periaate, tietäen, että entalpian muutoksella viitataan reaktioiden lämmönmuutokseen, kun ne annetaan jatkuvalle paineelle, on sanoa, että järjestelmän netto -entalpian muutos ei riipu polusta, jolla seuraa alkuperäisen tilan ja loppua.
Termodynamiikan ensimmäinen laki
Tämä laki liittyy niin luonnostaan termokemiaan, että toisinaan sekoittuu toiseen inspiroimaan; Joten tämän lain valojen antamiseksi on aloitettava sanomalla, että sen juuret ovat myös energiansäästön periaatteessa.
Joten termodynamiikka ei vain ota huomioon lämpöä energiansiirron muodossa (kuten termokemia), vaan sisältää myös muita energiamuotoja, kuten sisäistä energiaa (TAI-A.
Joten järjestelmän sisäisen energian vaihtelu (ΔU) annetaan sen alkuperäisten ja lopullisten tilojen välisellä erolla (kuten Hess -laissa havaitaan).
Kun otetaan huomioon, että sisäinen energia koostuu saman järjestelmän kineettisestä energiasta (hiukkasten liike) ja potentiaalisesta energiasta (hiukkasten välisistä vuorovaikutuksista), voidaan päätellä, että on muitakin tekijöitä, jotka vaikuttavat kunkin järjestelmän tilan ja ominaisuuksien tutkimiseen.
Termokemiasovellukset
ThermoChemistryllä on useita sovelluksia, osa näistä mainitaan alla:
- Tietyissä reaktioissa energiamuutosten määrittäminen kalorimetrian avulla (lämmönmuutosten mittaus tietyissä eristetyissä järjestelmissä).
- Järjestelmän entalpiamuutosten vähentäminen, vaikka niitä ei voida tietää suoralla mittauksella.
- Lämmönsiirtojen analyysi, joka on tuotettu kokeellisesti, kun siirtymämetallien kanssa olevia organometallisia yhdisteitä muodostuu.
- Energiamuutoksien (lämmössä) tutkimus, joka on annettu yhdisteissä, jotka koordinoivat polyamiineja metallien kanssa.
- P-DIC: ien metallilinkin ja β-DIC-yhdistyneiden metallien metallien metallien metallilinkin entalpian määrittäminen.
- Aikaisempien sovellusten lisäksi termokemiaa voidaan käyttää määrittämään suuri määrä parametreja, jotka liittyvät muun tyyppisiin energia- tai tilafunktioihin, jotka määrittelevät järjestelmän tilan tietyllä hetkellä.
- Thermokemiaa käytetään myös lukuisten yhdisteominaisuuksien tutkimuksessa, kuten titrauskalorimetriassa.
Viitteet
- Wikipedia. (S.F.-A. Termokemia. Haettu jstk.Wikipedia.org
- Chang, R. (2007). Kemia, yhdeksäs painos. Meksiko: McGraw-Hill.
- Librettexts. (S.F.-A. Thermokemia - katsaus. Saatu kemikolta.Librettexts.org
- Tyagi, P. (2006). Termokemia. Palautettu kirjoista.Google.yhteistyö.mennä
- Ribeiro, m. -Lla. (2012). Termokemia ja sen sovellukset kemiallisiin ja biokemiallisiin järjestelmiin. Saatu kirjoista.Google.yhteistyö.mennä
- Singh, n. B -., S, s. S., Ja Singh,. K -k -. (2009). Fysikaalinen kemia, osa 2. Palautettu kirjoista.Google.yhteistyö.mennä

