Natriumtiosulfaatti (Na2S2O3)

- 2400
- 133
- Dr. Travis Reichert
 Natriumtriosulfaattisuolat. Lisenssillä
Natriumtriosulfaattisuolat. Lisenssillä Mikä on natriumtriosulfaatti?
Hän natriumitiosulfaatti tai natrium hyposulfiitti (NA2S2JOMPIKUMPI3) Se on tärkeä epäorgaaninen suola, jolla on useita lääketieteellisiä käyttötarkoituksia. Se on saatavana myös pentahydraattisuolasi (na2S2JOMPIKUMPI3.5H2JOMPIKUMPI).
Se on ioninen yhdiste, jonka muodostaa kaksi natriumkationia (Na+) ja negatiivisesti ladattu tiosulfaatti -anionia (S2JOMPIKUMPI3-;. Kiinteä on monokliinisessä kiteisessä rakenteessa.
Natriumtriosulfaatti voi valmistaa lämmitysrikkiä vesipitoisella natriumsulfiteliuoksella tai vesipitoisella natriumhydroksidiliuoksella.
6NAOH + 4S → NA2S2JOMPIKUMPI3 + Toinen2S + 3H2JOMPIKUMPI
Tämä on lääke, joka on maailman terveysjärjestön välttämättömien lääkkeiden luettelossa, tehokkaimmat ja turvallisimmat lääkkeet, joita tarvitaan terveysjärjestelmässä.
Fysikaaliset ja kemialliset ominaisuudet
- Natriumtriosulfaatin molekyylipaino on 158,11 g/mol vedettömän muodon suhteen ja 248,18 g/mol pentahydraattien muotoon.
- Esittelee tiheyden 1 667 g/ml.
- Natriumtiosulfaatti on väritön monokliininen kide ilman ominaisia aromia. Tämä kiinteä kiinteä kiinteä kiinteä aine on kukistanut, mikä tarkoittaa, että se voidaan pelkistää pölyksi itsessään kiteyttämisveden menettämällä, kun se altistetaan ilmalle.
- Yhdisteessä on 48 ° C: n sulamispiste pentahydraattimuodolle, ja 100 ° C: sta se alkaa hajottaa.
- Sitten eräs2S2JOMPIKUMPI3 Se on erittäin liukeneva veteen, kykenee liuottamaan 70 grammaa 100 millilitraa kohti liuotinta. Yhdiste on käytännössä liukenematon etanoliin.
Voi palvella sinua: absorptiospektri- Natriumtriosulfaatti on neutraali suola, joka dissosioituu helposti vedessä natrium- ja tiosulfaatti -ionien antamiseksi. Naa2S2JOMPIKUMPI3 Se on vakaa kiinteä kiinteä olosuhteissa, mutta se hajoaa kuumennettaessa natriumsulfaatin ja natriumpolysulfidin antamiseksi:
4NA2S2JOMPIKUMPI3 → 3NA2Sw4 + Naa2S5
- Se hajoaa myös, kun sitä käsitellään laimennetuilla hapolla rikki- ja rikkidioksidin aiheuttamiseksi (kutsutaan kelloreaktioksi):
Naa2S2JOMPIKUMPI3 + 2HCL → 2NACL + S + SO2 + H₂o
- Stoikiometrisesti reagoi (ekvimolaarisina määrinä) vesipitoisilla jodiliuoksilla, joten sitä käytetään laajasti laboratorioissa jodipohjaisiin asteisiin.
Reaktiivisuus ja vaarat
Natriumtriosulfaatti ei ole myrkyllistä materiaalia, ja sitä käytetään lääketieteellisiin tarkoituksiin. Kuitenkin, kun se hajoaa, se tuottaa myrkyllisiä rikkioksidihöyryjä, jotka voivat aiheuttaa silmien, ihon ja limakalvojen ärsytystä.
Yhdiste voi ärsyttää silmiä, ihoa ja hengitysteiden. Aine on myrkyllistä keuhkoihin ja limakalvoihin. Toistuva tai pitkäaikainen altistuminen aineelle voi aiheuttaa vaurioita näille elimille.
Jos yhdiste joutuu kosketuksiin silmien kanssa, piilolinssit on tarkistettava ja poistettava, jos ne kuljettavat. Silmät, joissa on runsaasti vettä.
Ihokosketuksessa olevaa aluetta, joka on vähintään 15 minuutin ajan, on huuhdeltava heti, kun taas saastuneet vaatteet ja kengät poistetaan.
Sinun on peitettävä iho, joka on ärtynyt pehmentävällä. Pese vaatteita ja kenkiä ennen kuin käytät niitä uudelleen. Jos kosketus on vakava, pese desinfiointiaineella ja peitä antibakteerisella kermalla saastunut iho.
Voi palvella sinua: happi: ominaisuudet, rakenne, riskit, käyttötarkoituksetHengityksen tapauksessa uhri on siirrettävä uuteen paikkaan. Jos et hengitä, keinotekoinen hengitys annetaan. Jos hengitys on vaikeaa, happi on annettava.
Jos yhdiste nautitaan, oksentelua ei tule indusoida, ellei lääketieteellinen henkilöstö ilmoita sitä. Löysää tiukkoja vaatteita, kuten paidan kaula, vyö tai solmio.
Kaikissa tapauksissa on saatava välitön lääketieteellinen hoito.
Sovellukset
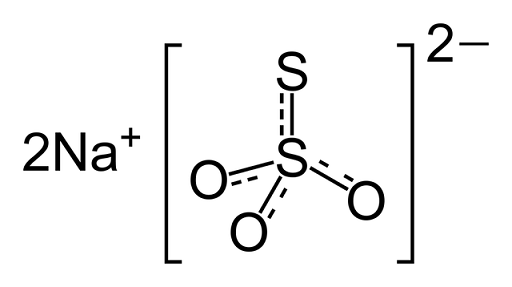 Natriumtriosulfaatin kemiallinen rakenne
Natriumtriosulfaatin kemiallinen rakenne Lääke
- Natriumtiosulfaattia voidaan käyttää vähentämään joitain sisplatiinin sivuvaikutuksia (syöpälääke).
- Sitä käytetään ekstravasaation hoidossa kemoterapian aikana. Natriumtriosulfaatti estää kudoksen alkyloinnin ja tuhoamisen tarjoamalla substraatin vuokra -aineisiin, jotka ovat tunkeutuneet ihonalaisiin kudoksiin.
- Sitä käytetään myös toisen lääkkeen kanssa syanidimyrkytyksen hätäkäsittelyssä.
Tässä hoidossa natriumnitriitti injektoidaan laskimonsisäisesti hemoglobiinin tuottamiseksi, joka yhdistetään syanidi -ioniin, kääntäen sen väliaikaisesti cianemetoglobiinimuotoon. Myöhemmin natriumtriosulfaatti injektoidaan.
- Se toimii substraattina Rodanasa -entsyymille, joka katalysoi syanidin muuntamista paljon vähemmän myrkylliseksi tiokianaatiksi, joka on erittynyt virtsaan.
- Sitä käytetään myös kalsifilaksin hoitoon ihmisillä hemodialyysissä terminaalisen munuaissairauden kanssa. Ilmeisesti ei ole täysin ymmärretty ilmiö, jolloin tämä aiheuttaa vakavaa metabolista asidoosia joillakin potilailla.
Jodometria
- Natriumtiosulfaatti reagoi stoikiometrisesti jodin kanssa jodidin antamiseksi reaktion mukaan:
Voi palvella sinua: Ketonit: Tyypit, ominaisuudet, nimikkeistö, käyttötarkoitukset, esimerkitToinen2S2JOMPIKUMPI3 + I2 → s4JOMPIKUMPI62 - + 2i-
Tämä ominaisuus tekee yhdisteestä, jota käytetään otsikkona jodin määrittämisessä.
- Tätä erityistä käyttöä voidaan luoda veden happipitoisuuden mittaamiseen pitkien reaktioiden avulla Winkler -testissä liuenneen happea varten.
- Sitä käytetään myös tiettyjen yhdisteiden pitoisuuksien tilavuusarvioinnissa liuoksessa (esimerkiksi vetyperoksidi) ja klooripitoisuuden arvioinnissa kaupallisessa valkaisujauheessa ja vedessä.
Vesivedet
- Natriumtriosulfaattia käytetään veden paljastamiseen, mukaan lukien klooritasojen aleneminen käytettäväksi akvaarioissa ja uima -altaissa ja kylpylöissä sekä vedenkäsittelylaitoksissa takaosan pesuveden käsittelemiseksi, joka on perustettu ennen sen vapautumista jokiin.
Pelkistysreaktio on analoginen jodin pelkistysreaktion kanssa, tiosulfaatti vähentää hypokloriittia (aktiivinen aineosa valkaisuaineessa) ja sen tekemällä se hapettaa sulfaattiin. Koko reaktio on:
4naclo + na2S2JOMPIKUMPI3 + 2NAOH → 4NACL + 2NA2Sw4 + H2JOMPIKUMPI
Kullanpoisto
Natriumtriosulfaatti on komponentti, jota käytetään vaihtoehtoisena huuhtoutumisaineena syanidille kullan uuttamista varten. Se muodostaa kuitenkin voimakkaan liukoisen kompleksin kulta -ionien (i), [AU: n kanssa (S2JOMPIKUMPI3-A2-3-.
Tämän lähestymistavan etuna on, että tiosulfaatti ei ole olennaisesti myrkyllistä ja että tiosulfaatti voidaan suodattaa mineraalityypit, jotka ovat tulenkestäviä kultasyanraatioon.
Viitteet
- HSDB: Natriumtiosulfaatti. Toxnetistä palautettu.Nlm.NIH.Hallitus.
- Turvallisuustietolomake Natrium -tiosulfaatti vedetön. Sciencelabista toipunut.com.

