Tolueenirakenne, ominaisuudet, käytöt, hankkiminen
- 1203
- 275
- Ronald Reilly
Hän Tolueeni Se on aromaattinen hiilivety, jonka tiivistetty kaava on c6H5CH3 tai phch3 Ja se koostuu metyyliryhmästä (CH3) yhdessä bentseenirenkaan tai fenyyliryhmän (pH) kanssa. Sitä löytyy luonnollisesti raakaöljystä, hiilen, tulivuoren säteilyssä ja joissain puissa, kuten Etelä -Tolú de América.
Tätä tyypillistä haju -liuotinta käytetään pääasiassa teollisena raaka -aineena ja maalin laimentajana. Sitä käytetään myös kissojen ja koirien, kuten askaridien ja AnyLostomes, eliminointiin.
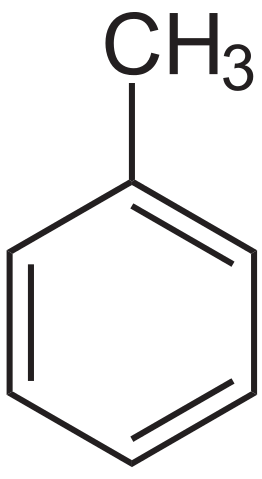
 Tolueenirakenteinen kaava. Lähde: Neurotoger Wikipedian kautta.
Tolueenirakenteinen kaava. Lähde: Neurotoger Wikipedian kautta. Pierre-Joseph Pelletier ja Philippe Walter, vuonna 1837, eristettiin ensimmäistä kertaa mäntyöljystä Pierre-Joseph Pelletier. Myöhemmin Henri Etienne Sainte-Claire DeVille eristi sen vuonna 1841 Tolú-balsamista ja huomautti, että sen tuote oli samanlainen kuin aiemmin eristetty. Vuonna 1843 Berzelius kastoi hänet Toluiniksi.
Suurin osa tolueenista saadaan sivuttaisina tai toissijaisena tuotteena kaasuntuotantoprosesseissa ja hiilen muuntamisessa koksiksi. Sitä tuotetaan myös laboratoriossa tehdyt reaktiot, esimerkiksi bentseenireaktio metyylikloridin kanssa.
[TOC]
Rakenne
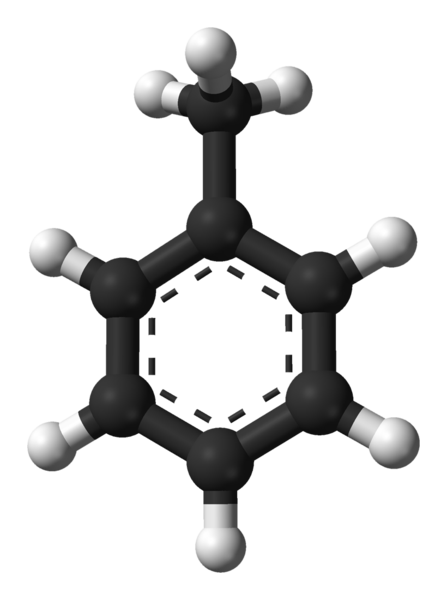 Tolueenin molekyylirakenne. Lähde: Ben Mills Wikipedian kautta.
Tolueenin molekyylirakenne. Lähde: Ben Mills Wikipedian kautta. Ylemmässä kuvassa meillä on tolueenin molekyylirakenne, jota edustaa pallo- ja tankojen malli. Huomaa, että se näyttää täsmälleen samalta kuin osoitettu rakenteellinen kaava, erolla, että se ei ole tasainen molekyyli kokonaan.
Bentseenirenkaan keskellä, jota tässä tapauksessa voidaan nähdä fenyyliryhmänä, pH, sen aromaattinen luonne korostetaan katkoviivojen kautta. Kaikilla hiiliatomeilla on SP -hybridisaatio2, Lukuun ottamatta CHO -ryhmää3, jonka hybridisaatio on SP3.
Tästä syystä molekyyli ei ole täysin tasainen: Cho -hydrogens3 Ne sijaitsevat bentseenirengastason eri kulmissa.
Voi palvella sinua: ionisaatiovakioTolueeni on apolaarinen, hydrofobinen ja aromaattinen molekyyli. Sen molekyylien väliset vuorovaikutukset perustuvat Lontoon dispergoiviin voimiin ja Dipolo-Dipolo-vuorovaikutuksiin, koska renkaan keskus on ”ladattu” CH: n tarjoamasta elektronisesta tiheydestä3; Kun taas vetyatomilla on alhainen elektroninen tiheys.
Siksi tolueenilla on monentyyppisiä molekyylien välisiä vuorovaikutuksia, jotka pitävät niiden nestemäisen koheesion molekyylit. Tämä heijastuu sen kiehumispisteessä, 111 ° C, mikä on korkea ottaen huomioon, että se on apolaarinen liuotin.
Ominaisuudet
Fyysinen ulkonäkö
Väritön ja läpinäkyvä neste
Moolimassa
92 141 g/mol
Haju
Makea, hehtaarin ja samanlainen kuin bentseeni
Tiheys
0,87 g/ml 20 ° C: ssa
Sulamispiste
-95 ºC
Kiehumispiste
111 ºC
Liukoisuus
Tolueenilla on halveksittava liukoisuus veteen: 0,52 g/l 20 ° C: ssa. Tämä johtuu tolueenin ja veden välisen napaisuuseron eroista.
Toisaalta tolueeni on liukoinen tai tässä tapauksessa sekoittuva etanolilla, bentseenillä, etyylieetterillä, asetonilla, kloroformilla, jääetikkahapolla ja hiilidisulfidilla; Eli se on parempi liuotettuna vähemmän polaarisia liuottimia.
Taittumisindeksi (nD -d-A
1 497
Goo
0,590 CP (20 ºC)
sytytyspiste
6 ºC. Tolueenia on manipuloitava kaasun uutettavissa leireissä ja mahdollisimman kaukana mistä tahansa liekistä.
Höyryn tiheys
3.14 Ilmasuhteessa = 1. Toisin sanoen heidän höyrynsä ovat kolme kertaa tiheämpiä kuin ilma.
Höyrynpaine
2.8 kPa 20 ° C: ssa (noin 0.27 ATM).
Itsekiinnityslämpötila
480 ° C
Hajoaminen
Voi reagoida voimakkaasti hapettavien materiaalien kanssa. Kun hän on kuumennut hajoamiseen, hän emittoi hehtaarin ja ärsyttävän savua.
Pintajännitys
29,46 mn lämpötilassa 10 ºC
Dipolaarinen hetki
0,36 D
Reaktiivisuus
Tolueeni on alttiina klooralle ortoklorotolueenin ja para-clloroTolueenin tuottamiseksi. On myös helppo nitrifioida nitrotolueenin tuottamiseksi, joka on väriaineiden raaka -aine.
Voi palvella sinua: atomipainoOsa tolueenista yhdistetään kolmeen typpihapon osaan aiheuttamaan trinitrotolueenia (TNT): Yksi tunnetuimmista räjähteistä.
Samoin tolueeni kokee sulfonaation O-toluen-sulfonisten ja p-toluen-sulfonihapojen tuottamiseksi, jotka ovat raaka-aine väriaineiden ja sakkariinin valmistukseen.
Tolueenimetyyliryhmä kokee vedyn menetyksen vahvan emäksen vaikutuksesta. Metyyliryhmä on myös alttiita hapettumiselle, joten se reagoi kaliumpermanganaatin kanssa aiheuttamaan bentsooisia ja bentsaldehydihappoa.
Sovellukset
Teollisuuden edustajat
 TONT, kaikkein symbolisin räjähde, tapahtuu tolueenilla pääraka -aineena. Lähde: Pixabay.
TONT, kaikkein symbolisin räjähde, tapahtuu tolueenilla pääraka -aineena. Lähde: Pixabay. Tolueenia käytetään maalauksien, maalien laimennusten, kynsien kiillotettujen, liimojen tai pasta-, lakka-, musteiden, nylon-, muovi-, polyuretaanivaahdon, useimpien öljyjen, vinyylielinten, lääkkeiden, lääkkeiden, väriaineiden, hajusteiden (Räjähteiden (TNT) kuumin.
Samoin tolueenia käytetään toluenosulfonadojen muodossa pesuaineen valmistuksessa. Tolueenilla on myös suuri merkitys muovisementtien, kosmeettisten värjäyspankkien, pakesaneston, musteiden, asfaltin, pysyvien markkerien, kosketussementtien jne.
Liuotin ja laimennus
Tolueenia käytetään maalausten laimennuksessa, mikä helpottaa sen käyttöä. Sitä käytetään polystyreenisarjojen reunojen liuottamiseen, mikä mahdollistaa niiden osien liiton, jotka muodostavat mittakaavamallit. Lisäksi sitä käytetään kasvien luonnontuotteiden uuttamiseen.
Toluene on kaiverretussa reiässä käytetty muste -liuotin. Kumin ja tolueenin kanssa sekoitettuja sementtejä käytetään suuren määrän tuotteiden peittämiseen. Samoin tolueenia käytetään liuottimena painettuina musteissa, lakkoissa, nahkatonnereissa, liimalla ja desinfiointiaineilla.
Voi palvella sinua: molaarinen absorboivaJa vielä mielenkiintoisempaa, tolueenia käytetään hiilen nanomateriaalien (kuten nanoputkien) ja Fullerenosin liuottimena.
Toiset
Bentseenin, tolueenin ja ksyleenin (BTX) seos lisätään bensiiniin sen oktaanin lisäämiseksi. Tolueeeni on lisäaine lentokonekaasusta ja korkean oktaanireservistä. Sitä käytetään myös NAFTA: n kehittämisessä.
Tolueeni auttaa joidenkin ascáridien ja anquilostomos -lajien poistamisessa sekä teniaja, jotka ovat kissojen ja koirien loisia.
Saada
Suurin osa tolueenista saadaan raakaöljyn tislattuista tuotteista, jotka on muodostettu hiilivetypyrolyysin aikana (höyryn halkeaminen). Öljyhöyryjen katalyyttinen uudistus edustaa 87 % tuotetusta tolueenista.
Ylimääräinen 9 % tolueenista pyrolyysibensiinistä, joka on tuotettu eteenin ja propeenin valmistuksen aikana.
Koksi -uunien hulla -terva edustaa 1 % tuotetusta tolueenista, kun taas loput 2 % saadaan venytyksen valmistuksen sivutuotteena.
Vahingolliset vaikutukset
Toluene on liuotin, joka hengitetään korkealle, koska sillä on huumausaine, joka vaikuttaa keskushermoston toimintaan. Tolueeni tulee kehoon nauttimista, hengittämistä ja imeytymistä ihon läpi.
Voi tapahtua 200 ppm, viritys, euforia, hallusinaatiot, vääristynyt käsitys, päänsärky ja huimaus. Vaikka korkeampi tolueenialtistuksen tasot voivat tuottaa masennusta, uneliaisuutta ja stuporia.
Kun hengitys ylittää pitoisuuden 10.000 ppm, pystyy tuottamaan henkilön kuoleman hengitysvajeiden vuoksi.
Viitteet
- Graham Solomons t.W -., Craig B. Freedle. (2011). Orgaaninen kemia. (10th Painos.-A. Wiley Plus.
- Carey f. (2008). Orgaaninen kemia. (Kuudes painos). MC Graw Hill.
- Morrison ja Boyd. (1987). Orgaaninen kemia. (Viides painos). Addison-Wesley Iberoamericana.
- Kansallinen bioteknologiatietojen keskus. (2020). Tolueeni. Pubchem -tietokanta., CID = 1140. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Wikipedia. (2020). Tolueeni. Haettu: vuonna.Wikipedia.org
- Engineering Toolbox, (2018). Tolueeni - Termofysikaaliset ominaisuudet. [Online] toipunut: EngineeringToolbox.com
- Vedantu. (S.F.-A. Tolueeni. Toipunut: Vedantu.com
- « Tuhoava häiriökaava ja yhtälöt, esimerkit, liikunta
- Polyvinyylipirrolidonirakenne, ominaisuudet, käytöt, sivuvaikutukset »

