Transaminaatio
- 3131
- 733
- Sheldon Kuhn
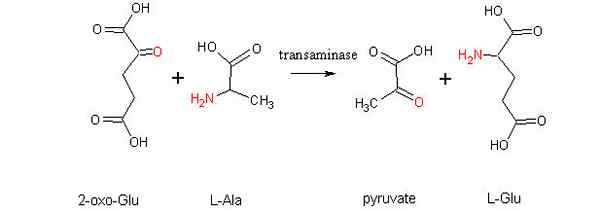
 Aminotransferenssireaktion kaavio aminohapon ja alfa-zoasidin välillä (lähde: Alcibiades Wikimedia Commonsin kautta)
Aminotransferenssireaktion kaavio aminohapon ja alfa-zoasidin välillä (lähde: Alcibiades Wikimedia Commonsin kautta) Mikä on transaminointi?
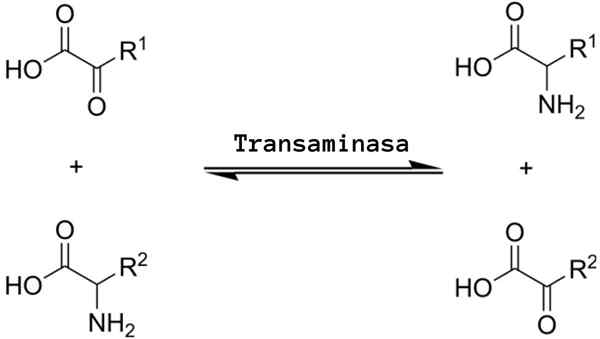
Se transaminaatio Se on eräänlainen kemiallinen reaktio, joka toimii aminohapporyhmien "uudelleenjakautumisessa", koska se ympäröi palautuvia aminaatioprosesseja (aminoryhmän lisääminen) ja sydänsärky (aminoherryhmän eliminointi), joita katalysoidaan spesifisillä entsyymeillä tunnetaan transaminaasina tai aminotransferaasina.
Yleinen transaminointireaktio merkitsee aminohapon ja minkä tahansa a-Zo--tooatin välistä vaihtoa, jossa aminohuryhmän vaihto tuottaa ensimmäisen substraatin aminohapon ketoasidiversion ja ensimmäisen a-zo-ekootoasidi-substraatin aminohappoversion ja aminohappoversion.
Yleensä vaihdettu aminohuryhmä on amino "alfa", ts. Se, joka osallistuu peptidiyhteyksien muodostumiseen ja joka määrittelee aminohappojen rakenteen, vaikka reaktiot, joihin liittyy muita aminoryhmiä, jotka ovat läsnä eri asemissa Erilaisia asentoja voi esiintyä.
Lysiiniä, trooniinia, proliinia ja hydroksiproliinia, kaikki aminohapot osallistuvat transaminointireaktioihin, vaikka histidiinille, seriinille, menetelmälle ja fenyylialaniinille on kuvattu transaminaaseja, mutta niiden metaboliset reitit eivät tarkoita tämän tyyppisiä reaktioita.
Braunstein ja Kritzmann löysivät vuonna 1937 aminohappojen ja a-kethoacidien väliset transaminointireaktiot, ja siitä lähtien niihin on tehty intensiivisiä tutkimuksia, koska niitä esiintyy monissa eri organismien kankaissa ja eri tarkoituksiin.
Esimerkiksi ihmisillä transaminaasit jakautuvat laajasti kehon kudoksiin ja ovat erityisen aktiivisia sydämen lihaskudoksessa, maksassa, luurankojen lihaskudoksessa ja munuaisissa.
Reaktiomekanismi
Transaminaatioreaktiot merkitsevät enemmän tai vähemmän samaa mekanismia. Kuten edellä mainittiin, nämä reaktiot tapahtuvat aminohapon ja a-zo-CID: n välisen aminoryhmän palautuvana vaihtoina.
Voi palvella sinua: Keraamiset materiaalit: ominaisuudet, tyypit, esimerkitNämä reaktiot riippuvat yhdisteestä, joka tunnetaan fosfaattipyridoksaalina, B6-vitamiinin johdannaisena, joka osallistuu aminoryhmän kuljettajana ja joka sitoutuu transaminaasientsyymeihin muodostaen schiff-emäksen tämän molekyylin aldehydiryhmän ja a-aminon välillä. Lysiinitähde entsyymin aktiivisessa paikassa.
Fosfaattipyridoksaalin ja lysiinitähteen välinen liitto aktiivisessa kohdassa ei ole kovalenttinen, vaan se annetaan lysiinin positiivisen typen positiivisen kuorman ja pyridoksaalin negatiivisen kuormituksen välillä pyridoksaalin välillä.
Reaktion aikana substraattina toimiva aminohappo syrjäyttää lysiinitähteen ε-amino-ryhmän aktiiviseen kohtaan, joka osallistuu schiff-emäkseen pyridoksaalin kanssa.
Samaan aikaan pari aminohappo-alfa-hiilielektroneja poistetaan ja siirretään pyridiinirenkaaseen, joka säveltää fosfaattipyridoksaalin (positiivisella varauksella) ja sitten ne ”toimitetaan” a-zo-zidiin, joka toimii toisena substraattina.
Tällä tavoin pyridoksaalinen fosfaatti ei osallistu aminohappojen ja aminohappojen ja tranohappojen välisten a-ecotoasidien väliseen siirtoon tai kuljetukseen, jotka ovat transaminaasien substraattia, mutta toimii myös elektronien "pesuallana" helpottaen dissosioitumista. Alfa -happovety.
Yhteenvetona voidaan todeta, että ensimmäinen substraatti, aminohappo, siirtää aminoryhmänsä fosfaatti-pyridoksaaliin, josta se siirretään myöhemmin toiseen substraattiin, a-Zo-ekotoidiin, muodostukseen, välituotteessa, välittäjäyhdisteeksi, joka tunnetaan pyridoksamiinina fosfaatti.
Voi palvella sinua: PylväskromatografiaTransaminaatiofunktio
Transaminaasientsyymejä löytyy yleensä sytosolista ja mitokondrioista ja työskentelevät erilaisten aineenvaihduntareittien integroinnissa.
Esimerkiksi glutamaattidehydrogenaasi voi esimerkiksi muuttaa glutamaatin ammoniumiksi, NADH: ksi (tai NADPH: ksi) ja α-zetoglutaraatiksi, jotka voivat päästä trikarboksyylihappojen ja toiminnan energiantuotannossa.
Tämä entsyymi, joka on mitokondriaalimatriisissa, edustaa haarapistettä, joka yhdistää aminohappojen energian aineenvaihduntaan, joten kun solusta puuttuu riittävä energia hiilihydraattien tai rasvojen muodossa toimimaan, se voi vuorotellen käyttää joitain aminohappoja samoille tarkoitus.
Entsyymin (glutamaattidehydrogenaasin) muodostuminen aivojen kehityksen aikana on välttämätöntä ammoniumin vieroitusvallan torjunnassa, koska on osoitettu, että joidenkin henkisen vajaatoiminnan tapaukset liittyvät tämän alhaiseen aktiivisuuteen, mikä johtaa ammoniumin kertymiseen, joka on haitallista aivojen terveydelle.
Joissakin maksasoluissa transaminointireaktioita voidaan käyttää myös gluconeogenees -glukoosisynteesiin.
Glutamiini muuttuu glutamaatiksi ja ammoniumiksi glutaminaasientsyymillä. Sitten glutamaatti muunnetaan a-zetoglutaraatiksi, joka tulee Krebs-sykliin ja sitten glukoneogeneesiin. Tämä viimeinen askel tapahtuu Malon, joka on yksi reitin tuotteista, ansiosta kuljetetaan mitokondrian ulkopuolella sukkulan avulla.
Tämä sukkula jättää a-cetoglutaraatin Málica-entsyymin armoille, mikä tekee siitä pyruvaatin. Kaksi pyruvaattimolekyyliä voidaan muuntaa silloin glukoosimolekyylin kautta glukoneogeneesin kautta.
Voi palvella sinua: tasainen taustapulloEsimerkit
Yleisimmät transaminointireaktiot liittyvät alaniiniaminohappoihin, glutamiinihappoon ja asparagiinihappoihin.
Jotkut aminotransferaasientsyymit voivat pyridoksaalisen fosfaatin lisäksi käyttää pyruvaattia "koentsyyminä", kuten transaminaasi-glutamaatin-palvaatin tapauksessa, joka katalysoi seuraavaa reaktiota:
glutamaatti + pyruvaatti ↔ alaniini + α-cetoglutaraatti
Lihassolut riippuvat tästä reaktiosta alaniinin tuottamiseksi pyruvaatista ja energian saamiseksi Krebs-syklin kautta a-zetogluttoinnin avulla. Näissä soluissa alaniinin käyttö energian lähteenä riippuu aminoryhmien eliminoinnista ammoniumioneina maksassa ureasyklin kautta.
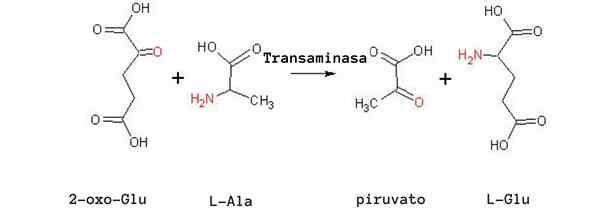 Alaniinin transaminointireaktio (lähde: Tomas Drab [julkinen alue] Wikimedia Commonsin kautta)
Alaniinin transaminointireaktio (lähde: Tomas Drab [julkinen alue] Wikimedia Commonsin kautta) Toinen erittäin tärkeä transaminaatioreaktio eri lajeissa on se, että entsyymi -aspartaatin aminotransferaasi:
L-spartato + α-ketoglutaraatti ↔ oksalastaatti + l-glutamaatti
Lopuksi, mutta ei vähäisimpänä, y-aminobutyrinen happojen transaminaatioreaktio (GABA), ei-proteiiniaminohappo keskushermostolle, joka toimii estävänä välittäjäaineena. Reaktiota katalysoi y-aminobutirinen transaminaasihappo ja se on enemmän tai vähemmän seuraavasti:
α-ketoglutaraatti + 4-aminobutanoiinihappo ↔ Glutamaatti + suppininen puoliksi auto
Suhteeninen puoliksi -puolipyöttö muunnetaan sucniinihapoksi hapettumisreaktiolla ja jälkimmäinen voi päästä Krebs -sykliin energiantuotantoa varten.

