Volframihistoria, ominaisuudet, rakenne, käyttää

- 2801
- 126
- Edgar VonRueden
Hän volframi, Wolframio tai Volframium on raskas siirtymämetalli, jonka kemiallinen symboli on w. Se sijaitsee jaksolla 6 jaksollisen taulukon ryhmän 6 kanssa ja sen atomiluku on 74. Hänen nimensä on kaksi etymologista merkitystä: kova kivi ja susi vaahto; Toinen johtuu siitä, että tämä metalli tunnetaan myös nimellä Wolframio.
Se on hopeaharmaa metalli ja vaikka se olisi hauras, siinä on suuri kovuus, tiheys ja korkea fuusio- ja kiehumispisteet. Siksi sitä on käytetty kaikissa sovelluksissa, joihin liittyy korkeita lämpötiloja, paineita tai mekaanisia voimia, kuten porat, ammukset tai säteilypäästöt.
 Volframibaari osittain hapettuneella pinnalla. Lähde: Hi-Res-kuvat kemiallisista elementeistä [CC 3: lla.0 (https: // creativecommons.Org/lisenssit/by/3.0)]
Volframibaari osittain hapettuneella pinnalla. Lähde: Hi-Res-kuvat kemiallisista elementeistä [CC 3: lla.0 (https: // creativecommons.Org/lisenssit/by/3.0)] Tämän metallin tunnetuin käyttö kulttuurilla ja suositulla tasolla on sähköpulttien filamentit. Kuka on manipuloinut heitä, ymmärtää kuinka hauraita he ovat; Niitä ei kuitenkaan ole valmistettu puhtaasta volframista, joka on muokattavissa ja palloke. Lisäksi metallimatriisien, kuten seosten, se tarjoaa erinomaisen vastus- ja kovuuden.
Sille on karakterisoitu ja erotettu olevan metalli, jolla on korkein fuusiopiste, ja että se on myös tiheämpi kuin sama lyijy, vain muut metallit, kuten osmium ja iridium. Se on myös raskain metalli, jonka tiedetään täyttävän biologinen rooli kehossa.
Suurimmassa osassa sen ionisia yhdisteitä volgstate -anionin osallistuu, wo42-, joka voi polymeroitua aiheuttamaan klustereita happamassa väliaineessa. Toisaalta volframi voi muodostaa metallien välisiä yhdisteitä tai sterisoida metallien tai epäorgaanisten suolojen kanssa siten, että niiden kiinteät aineet hankkivat erilaisia muotoja tai konsistensseja.
Se ei ole kovin runsaasti maan aivokuoressa, sillä se on tonni vain 1,5 grammaa tätä metallia. Lisäksi, koska se on raskas elementti, sen alkuperä on galaktien välinen; Erityisesti supernovojen räjähdyksistä, joiden oli heitettävä volframiatomien ”suihkukoneet” planeetallemme niiden muodostumisen aikana.
[TOC]
Historia
Etymologia
Volframin tai Wolframion historiassa on kaksi kasvoja ja heidän nimensä: yksi sveitsiläinen ja toinen saksa. 1600 -luvulla Saksan ja Itävallan tällä hetkellä käyttämillä alueilla kaivostyöläiset työskentelivät kuparin ja tinan uuttojen parissa pronssien tuottamiseksi.
Siihen mennessä kaivostyöläiset tapasivat piikin prosessissa: siellä oli erittäin vaikea mineraali; Mineraali koostui Wolframiteista, (Faith, MN, MG) WO4, joka säilytti tai "syönyt" tinaa ikään kuin se olisi susi.
Tästä syystä tämän elementin etymologia, "susi" susi espanjaksi, susi, joka söi tinaa; ja vaahdon tai kerman "ram", jonka kiteet muistuttivat pitkää mustaa turkista. Se oli niin, että nimi 'Wolfram' tai 'Wolframio' syntyi näiden ensimmäisten havaintojen kunniaksi.
Vuonna 1758, Sveitsin puolella samanlaiselle mineraalille, Scheelita, Cawo4, Hänet nimitettiin 'Tung Sten', mikä tarkoittaa 'kovaa kiveä'.
Molemmat nimet, Wolframio ja volframi, käytetään laajasti keskenään, pelkästään kulttuuriin riippuen. Esimerkiksi Espanjassa ja Euroopan lännessä tämä metalli tunnetaan enemmän Wolframio; Amerikan mantereella volframin nimi hallitsee.
Tunnustaminen ja löytö
Sitten tiedettiin, että seitsemännentoista ja 1800 -luvun välillä oli kaksi mineraalia: Wolframite ja Scheelita. Mutta kuka vilkaisi, että muita metallia oli kuin muut? Niitä voidaan luonnehtia vain mineraaleiksi, ja juuri vuonna 1779 irlantilainen kemisti Peter Woulfe analysoi varovasti Wolframite ja päätteli Wolframiumin olemassaolon.
Se voi palvella sinua: perbromiinihappo (HBRO4): Ominaisuudet, riskit ja käytötSveitsin puolella, jälleen kerran, Carl Wilhelm Scheele pystyi eristämään volframin kuin wo3; Ja vielä enemmän, hän sai tuhaisen (tai wolframisen) hapon, H2Ora4 ja muut yhdisteet.
Tämä ei kuitenkaan riitä puhtaan metallin saavuttamiseen, koska tämä happo oli välttämätöntä vähentää; toisin sanoen sen kohteena sellaiselle prosessille, joka ei kykene happea ja kiteytyy metalliksi. Carl Wilhelm Scheelellä ei ollut asianmukaista menetelmää tälle kemialliselle pelkistysreaktiolle.
Täällä espanjalaiset veljet D'Aluyar, Fausto ja Juan José, jotka vähensivät molemmat mineraalit (Wolframite ja Scheelita) hiilellä, Bergaran kaupungissa, Bergaran kaupungissa. Kaksille annetaan ansio ja kunnia olla Wolframiumin tai metallisen volframin (W) löytäjät (W).
Teräkset ja sipulit
 Mikä tahansa polttimo, jossa on volframiehän. Lähde: Pxhere.
Mikä tahansa polttimo, jossa on volframiehän. Lähde: Pxhere. Kuten muutkin metallit, sen käyttö määrittele sen historiansa. Näkyvimpiä 1800-luvun loppuun mennessä olivat teräsvoiman seokset ja volframiekilpailu hiilen korvaamiseksi sähköisissä lamppuissa. Voidaan sanoa, että ensimmäisiä lamppuja, kuten tunnemme ne, markkinoitiin vuosina 1903-1904.
Ominaisuudet
Fyysinen ulkonäkö
Se on hopea ja kiiltävä harmaa metalli. Hauras, mutta suuri kovuus (ei sekava sitkeyteen). Jos kappale on erittäin puhtaasti.
Atominumero
74.
Moolimassa
183,85 g/mol.
Sulamispiste
3422ºC.
Kiehumispiste
5930ºC.
Tiheys
19,3 g/ml.
Sulamislämpö
52,31 kJ/mol.
Höyrystyslämpö
774 kJ/mol.
Molaarinen lämpökapasiteetti
24,27 kJ/mol.
Moh -kovuus
7.5.
Elektronegatiivisuus
2 36 Pauling -asteikolla.
Atomiradio
139
Sähkövastus
52.8 nω · m 20ºC.
Isotoopit
Se esiintyy pääosin viidessä isotoopissa: 182W -, 183W -, 184W -, 186W ja 180W -. 183 g/mol, joka keskimäärin näiden isotoopien (ja muiden kolmenkymmenen radioisoppien) atomimassat, jokaisella volframin tai Wolframiumin atomilla on noin sata kymmenen neutronia (74 + 110 = 184).
Kemia
Se on erittäin kestävä korroosiometallille, koska sen ohut kerros wo3 Suojaa sitä hapen, hapon ja alkalin hyökkäykseltä. Kun se on liuennut ja saostettu muihin reagensseihin, niiden suolat saadaan, joita kutsutaan Wolframatesiksi tai Tungstatsiksi; Niissä volframin hapettumistila on +6 (olettaen, että on olemassa kationien w6+-A.
Happuklusterointi
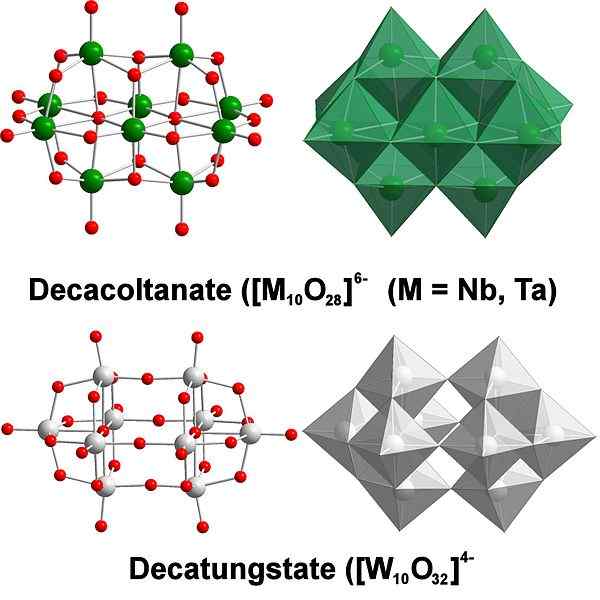 DecatungState, esimerkki volframipolyaksometaalaateista. Lähde: Scifanz [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]
DecatungState, esimerkki volframipolyaksometaalaateista. Lähde: Scifanz [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Kemiallisesti volframi on aivan erityinen, koska sen ionit yleensä ryhmitetään (klusterointi englanniksi) heteropolykidejen muodostamiseksi tai polyaksometalaatiksi. Mitä ne ovat? Ne ovat atomien ryhmiä tai klustereita, jotka sitoutuvat määrittelemään kolmiulotteisen rungon; Pääasiassa yksi, jolla on pallomainen häkkirakenne, jossa he "sulkevat" toisen atomin.
Kaikki alkaa Tungstate Anionista, wo42-, Happamassa väliaineessa on protonoitu (HWO4-) ja sidottu naapurimaiden muodostumiseen [w2JOMPIKUMPI7(VAI NIIN)2-2-; Ja tämä puolestaan liittyy toiseen [w2JOMPIKUMPI7(VAI NIIN)2-2- Alistuu [w4JOMPIKUMPI12(VAI NIIN)4-4-. Joten liuoksessa on useita polytungsettejä.
Voi palvella sinua: litiumkloridi (LICL): Ominaisuudet, riskit ja käytötParathungstate A ja B, [W7JOMPIKUMPI24-6- ja h2W -12JOMPIKUMPI4210-, vastaavasti ne ovat yksi kaikkein merkittävimmistä näistä polyadeista.
Siitä voi tulla haaste harkita sen luonnos- ja Lewis -rakenteita; Mutta periaatteessa riittää visualisoimaan ne oktaedra -sarjoina6 (Yläkuva).
Huomaa, että nämä harmahtavat oktaedrat lopulta määrittelevät DeCatungstate, poliittinen osake; Jos heteroátomo lukittuu sisälle (esimerkiksi fosfori), se olisi silloin polyaksometalaatti.
Elektroninen rakenne ja kokoonpano
Kiteinen vaihe
Volframiatomit määrittelevät kuutiometrin rakenteen, joka on keskittynyt rungon kanssa (BCC, kirjoittanut Kehonkeskeinen kuutio-A. Tämä kiteinen muoto tunnetaan α -faasina; Vaikka β -faasi on myös kuutio, mutta hieman tiheä. Sekä faasit tai kiteiset muodot, a ja β, voivat esiintyä tasapainossa normaaleissa olosuhteissa.
A -faasin kiteiset jyvät ovat isometrisiä, kun taas β -faasin muistuttavat pylväät. Riippumatta siitä, kuinka lasi on, tässä hallituksessa. Muutoin korkeat sulamis- ja kiehumispisteitä ei voitu selittää tai volframin korkea kovuus ja tiheys.
Metallilinkki
Volframiatomien on jotenkin oltava hyvin yhtenäinen. Arvioinnin nostamiseksi tämän metallin elektroninen kokoonpano tulisi havaita ennen:
[Xe] 4f145 D46s2
5D -orbitaalit ovat erittäin suuria ja epäselviä, mikä tarkoittaisi, että kahden läheisen atomin välillä w on tehokkaita kiertoratoja. Myös Orbitals 6s myötävaikuttaa tuloksena oleviin bändeihin, mutta vähemmässä määrin. Vaikka 4F -kiertoradalla on "erittäin syvällä" ja niiden panos metallisiin linkkeihin on alhaisempi.
Tämä, atomien koko ja kiteiset jyvät ovat muuttujia, jotka määrittävät volframin kovuuden ja sen tiheyden.
Hapetustilat
Volframissa tai metallisessa wolframiumissa atomeilla W on nolla hapettumistila (W0 --A. Paluu elektroniseen kokoonpanoon 5D- ja 6S -kiertorauhat voivat "tyhjentää" elektronit riippuen siitä, onko W erittäin elektronegatiivisten atomien, kuten happea tai fluoria.
Kun kaksi 6S -elektronia menetetään, volframilla on hapetustila +2 (W2+), Mikä tuottaa sen atom -sopimuksen.
Jos menetät myös kaikki 5D -orbitaalisi elektronit, hapetustilastasi tulee +6 (W6+) Tästä eteenpäin siitä ei voi tulla positiivisempaa (teoriassa), koska sisäisen 4F -kiertoradan mukaan vaativat suuria energioita niiden elektronien poistamiseksi. Toisin sanoen positiivisin hapettumistila on +6, missä volframilla on vielä pieni.
Tämä volframi (VI) on erittäin stabiili happamissa olosuhteissa tai monissa hapetettuissa tai halogenoiduissa yhdisteissä. Muita positiivisia ja mahdollisia hapettumistiloja ovat: +1, +2, +3, +4, +5 ja +6.
Volframi voi myös saada elektroneja, jos ne yhdistetään vähemmän elektronegatiivisiin atomiin kuin hän. Tässä tapauksessa heidän atomit muuttuvat suuremmaksi. Se voi saada korkeintaan neljä elektronia; toisin sanoen hapetustila on -4 (W4--A.
Saada
Aikaisemmin mainittiin, että volframi löytyy Wolframite- ja Scheelita -mineraaleista. Prosessista riippuen heistä saadaan kaksi yhdistettä: volframioksidi, wo3, tai ammonium paratungstate, (NH4-A10(H2W -12JOMPIKUMPI42) · 4H2O (tai ATP). Jokainen niistä kaksi voidaan pelkistää metallisiksi W: ksi, jonka hiili yli 1050ºC.
Se voi palvella sinua: RAAULT -laki: Periaate ja kaava, esimerkit, harjoituksetSe ei ole taloudellisesti kannattavaa. Siksi on suositeltavaa tuottaa sitä pölyn muodossa, jotta se on kerran käsitellä muita metalleja seosten saamiseksi.
On syytä mainita, että Kiinan maailma on maa, jolla on suurin volframin tuotanto. Ja Yhdysvaltain mantereella, Kanadassa, Boliviassa ja Brasiliassa he miehittävät myös tämän metallin suurimmista tuottajista.
Sovellukset
 Volframikarbidiyhdiste: Esimerkki tämän metallin kovuudesta voidaan käyttää materiaalien imuttointiin ja kovettamiseen. Lähde: Yksinäisentti (Solulingangel) [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Volframikarbidiyhdiste: Esimerkki tämän metallin kovuudesta voidaan käyttää materiaalien imuttointiin ja kovettamiseen. Lähde: Yksinäisentti (Solulingangel) [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Joitakin tämän metallin tunnetuista käytöistä mainitaan alla:
-Hänen suolojaan käytettiin vanhojen teattereiden putken väritykseen.
-Yhdistettynä teräksellä, se kovettuu vielä enemmän, jopa pystyy vastustamaan mekaanisia leikkauksia suurilla nopeuksilla.
-Volframin sintrausfilamentteja on käytetty yli sata vuotta sähköisissä lamppuissa ja halogenoiduissa lampuissa. Lisäksi korkean sulamispisteensä vuoksi se on toiminut materiaalina katodiräteputkille ja rakettimoottorien suuttimille.
-Korvaa lyijyn ammusten ja radioaktiivisten kilpien valmistuksessa.
-Volfram -nanoklesia voidaan käyttää pH -herkässä nanodispositiivisessa.
-Volframikatalyyttejä käytettiin öljyteollisuuden rikkituotannon käsittelemiseen.
-Volframikarbidi on kaikista sen yhdisteistä, jotka kattavat enemmän käyttötarkoituksia. Leikkausten ja porausvälineiden vahvistamisesta tai sotilaallisten aseiden valmistuksesta puun, muovien ja keramiikan koneistamiseksi.
Riskit ja varotoimet
Biologinen
Koska se on suhteellisen harvinainen metalli maankuoressa, sen kielteiset vaikutukset ovat vähäisiä. Happamassa maaperässä polytumingses ei välttämättä vaikuta molybdaattien käyttämiin entsyymeihin; Mutta perusmaassa, WO42- Se puuttuu (positiivisesti tai negatiivisesti) MOO: n metabolisiin prosesseihin42- ja kupari.
Esimerkiksi kasvit voivat absorboida volframin liukoiset yhdisteet ja syömällä niitä eläimenä ja sitten heidän lihansa kuluttamisen jälkeen W -atomit saapuvat organismeihimme. Suurin osa on karkotettu virtsassa ja ulosteessa, ja vähän tiedetään, mitä muille heille tapahtuu.
Eläintutkimukset osoittivat, että kun suurilla volframijauhejauhejauheissa kehittyy oireita, jotka ovat samanlaisia kuin keuhkosyöpä.
Nielemisen mukaan aikuisen ihmisen olisi juoda tuhansia galloneita vettä, joka on rikastettu volframisuoloilla, jotta saadaan tuntuvaa kolinesteraasi- ja fosfataasientsyymien estämistä.
Fyysinen
Yleisesti ottaen volframi on vähän myrkyllinen elementti, ja siksi terveysvaurioille on vähän isäntäriskejä.
Metallisen volframin suhteen sinun tulee välttää sen pölyn hengittämistä; Ja jos näyte on kiinteä, on otettava huomioon, että se on erittäin tiheä ja että se voi aiheuttaa fyysisiä vaurioita, jos se putoaa tai osuu muihin pintoihin.
Viitteet
- Bell Terence. (S.F.-A. Volframi (Wolfram): Ominaisuudet, tuotanto, sovellukset ja seokset. Tasapaino. Toipunut: Tasapaino.com
- Wikipedia. (2019). Volframi. Haettu: vuonna.Wikipedia.org
- Lentech b.V. (2019). Volframi. Toipunut: lentech.com
- Jeff Desjardins. (1. toukokuuta 2017). Volframin historia, voimakkain luonnonmetalli maan päällä. Palautettu: VisualCapitalist.com
- Doug Stewart. (2019). Volframelementti tosiasiat. Toipunut: Chemicool.com
- Taide Fisher ja Pam Powell. (S.F.-A. Volframi. Nevadan yliopisto. Toipunut: Unce.a r.Edu
- Helmestine, Anne Marie, PH.D -d. (2. maaliskuuta 2019). Volframi- tai Wolfram -tosiasiat. Toipunut: Admingco.com

