Valina -ominaisuudet, toiminnot, rikkaat ruuat, edut
- 2378
- 711
- Alonzo Kirlin
Se Valina Se kuuluu 22 aminohappoa, jotka on tunnistettu proteiinien "emäksisiksi" komponenteiksi; Se tunnistetaan lyhenteellä "Val" ja kirjaimella "V". Tätä aminohappoa ei voida syntetisoida ihmiskehossa, joten se on luetteloitu ihmisille yhdeksän välttämättömän aminohapon ryhmään.
Monissa globaaleissa proteiineissa on sisä- ja leusiinijätteiden runsaasti, koska molemmat liittyvät hydrofobiset vuorovaikutukset ja ne ovat välttämättömiä rakenteen taivuttamisessa ja proteiinien kolmen dimensionaalisen konformaation suhteen.
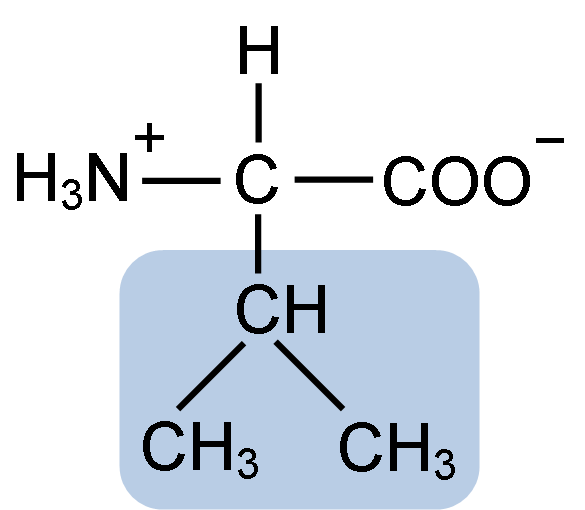
 Aminohappo-valiinin kemiallinen rakenne (lähde: Clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta)
Aminohappo-valiinin kemiallinen rakenne (lähde: Clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta) La Valina puhdistettiin ensimmäistä kertaa vuonna 1856 V: llä. Grup-Besanez haiman vesipitoisesta uutteesta. E -nimi "Valina" on kuitenkin keksinyt E. Fisher vuonna 1906, kun hän onnistui syntetisoimaan sen keinotekoisesti ja havaitsi, että sen rakenne oli hyvin samanlainen kuin arvokashappo, jota löytyi kasveista, joita yleisesti kutsutaan "Valerianas".
Valiini on yksi aminohapoista, joita löytyy tietyissä selkärankaisten jakautuneissa proteiineissa säilytettyissä paikoissa, esimerkiksi selkärankaisten sytokromi c: n 80 sijainnissa ovat leusiini, valiini, isoleusiini ja menetelmä samassa järjestyksessä samassa järjestyksessä.
Kudoksissa tai biomateriaaleissa, joissa on resistenttejä, kovia ja joustavia ominaisuuksia, kuten nivelsiteet, jänteet, verisuonet, langat tai verkko, on suuria määriä valinia, mikä tarjoaa joustavuutta ja vastustuskykyä hydrofobisten vuorovaikutusten ansiosta muiden aminohappojen kanssa.
Glutamaattitähteen korvaaminen yhdellä valiiinilla hemoglobiinin β -ketjussa, hapenkuljetuksesta vastaava proteiini veren avulla aiheuttaa huonoa muodostumista proteiinirakenteessa, joka aiheuttaa hemoglobiinia "S".
Tämä mutaatio tuottaa falciform -anemiaa tai drepanosytoosia, patologista tilaa, jossa punasolut saavat puolikuun tai ominaisen Hoz -muodon, joka erottaa ne normaalista, pyöristetystä ja litistetystä ulkonäöstä.
Joillakin eniten käytetyistä rikkakasvien torjunta -aineista on tällä hetkellä aktiivisia yhdisteitä sulfonyyliureaan ja metyylisulfometuroniin, jotka aiheuttavat vaurioita entsyymiasetolaktaattisyntaasia, joka on välttämätöntä valinin, leusiinin ja isoleuginin synteesin ensimmäiseen vaiheeseen. Näiden torjunta -aineiden aiheuttamat vahingot estävät yrttejä ja rikkakasvit voivat yleensä kehittyä.
[TOC]
Ominaisuudet
Valina on aminohappo, jolla on viiden hiilikarjan luuranko ja kuuluu aminohapporyhmään, jolla on alifaattiset sivuketjut. Sen hydrofobinen luonne on sellainen, että sitä voidaan verrata fenyylialaniiniin, leusiiniin ja isoleusiiniin.
Aminohapot, joilla on hiilivetyketjut R R- tai sivuketjuissa. Tässä ryhmässä ovat valiini, fenyylialaniini, leusiini ja isoleusiini.
Yleensä tämän ryhmän aminohappoja käytetään proteiinisynteesin sisäisinä rakenteellisina elementteinä, koska ne voidaan liittyä toisiinsa hydrofobisten vuorovaikutusten avulla, "pakenevat" vedestä ja monien proteiinien ominaisten rakenteellisten laskostumisten määrittäminen.
Sen molekyylipaino on noin 117 g/mol ja koska sen R- tai sivuketjuryhmä on haarautunut hiilivety, sillä ei ole kuormaa ja sen suhteellinen runsaus proteiinirakenteissa on vähän suurempi kuin 6%.
Rakenne
La Valina jakaa kaikkien aminohappojen yleisen rakenteen ja kolme tyypillistä kemiallista ryhmää: karboksyyliryhmä (COOH), aminohuryhmä (NH2) ja vetyatomi (-H). R- tai sivuketjuryhmässä siinä on kolme hiiliatomia, jotka antavat sille erittäin hydrofobiset ominaisuudet.
Voi palvella sinua: inertit olennot: ominaisuudet, esimerkit, erot elävien olentojen kanssaKuten kaikki "aminohapoiksi" luokiteltuihin kemiallisiin yhdisteisiin, valinissa on keskeinen hiiliatomi, joka on kiraalinen ja joka tunnetaan nimellä a -hiili, joihin neljä kemiallista ryhmää mainittu.
Valinin IUPAC-nimi on 2-3-amino-3-Butanóic.
Kaikkia aminohappoja löytyy D- tai L -muodosta, ja valiini ei ole poikkeus. L-arvoinen muoto on kuitenkin paljon runsaampi kuin D-alleiinimuoto ja lisäksi se on spektroskooppisesti aktiivisempi kuin muoto D.
L-arvo on muoto, jota käytetään soluproteiinien muodostumiseen, ja siksi se on kahdesta, biologisesti aktiivinen muoto. Se täyttää toiminnot, kuten ravitsemusmikrotravinteet kasveille, ihmisille metaboliitti, levät, hiivat ja bakteerit, monien muiden toimintojen joukossa.
Funktiot
Valina, vaikka se on yksi yhdeksästä välttämättömästä aminohaksosta, ei ole ylimääräinen rooli sen osallistumisessa proteiinisynteesiin ja metaboliitina omalla hajoamisreitillä.
Suuret aminohapot, kuten valiini ja tyrosiini, ovat kuitenkin vastuussa fibroiinin joustavuudesta, lajien lajien tuottamien silkkilankojen pääproteiinikomponentista Bombyx Mori, Yleisesti tunnetaan silkki- tai mulberry -puumatoja.
Kudokset, kuten valtimoveren sigamentit ja lasit, koostuvat kuitumaisesta proteiinista, joka tunnetaan nimellä elastiini. Tämä koostuu polypeptidiketjuista, joissa on toistuvia glysiini-, alaniini- ja valiini -aminohappoja koskevia sekvenssejä, mikä on tärkein jäännös proteiinilla.
Valina osallistuu hedelmien ominaishajuista vastaavien yhdisteiden tärkeimpiin synteesireiteihin. Valina -molekyylit muunnetaan estereiden ja alkoholien metyloituneiksi ja haarautuneiksi johdannaisiksi.
Elintarviketeollisuudessa
On olemassa monia kemiallisia lisäaineita, jotka käyttävät valiinia yhdessä glukoosin kanssa ruokahalttojen saamiseksi tietyissä kulinaarisissa valmisteissa.
100 ° C: n lämpötilassa näillä lisäaineilla on tyypillinen ruishaju ja yli 170 ° C: n haju kuumassa suklaassa, joten ne ovat suosittuja leipuri- ja leivonnaisalalla (leivonnaiset) elintarvikkeiden tuotannossa (leivonnaiset).
Nämä kemialliset lisäaineet käyttävät keinotekoisesti syntetisoitua L-valinia.
Biosynteesi
Kaikki haarautuneet ketjun aminohapot, kuten valiini, leusiini ja isoleusiini, syntetisoidaan pääasiassa kasveissa ja bakteereissa. Mikä tarkoittaa, että eläinten, kuten ihmisen ja muiden nisäkkäiden, on nieltävä näitä aminohappoja rikkaita ruokia voidakseen vastata heidän ravitsemusvaatimuksiinsa.
Yleensä valiiinin biosynteesi alkaa siirtämällä kaksi hiiliatomia hydroksietyyli -tyypin pyrofosfaatista pyruvaattiin entsyymin oketohydroxi -isomeerihappodektaasihappon vaikutuksella.
Kaksi hiiliatomia johdetaan toisesta pyruvaattimolekyylistä TPP-riippuvaisen reaktion kautta, joka on hyvin samanlainen kuin se, jota katalysoi entsyymidismikarboksylaasi-pyruvaatti, mutta jota dihydroksi-happea dehydraasi katalysoi.
Valina-aminotransferaasi sisältää lopuksi aminohuryhmän ketoasidiyhdisteeseen, joka johtuu etuosan dekarboksylaatiosta, joka muodostaa L-valiinin. Leusiini-, isoleusiini- ja valiine -aminohapolla on suuri rakenteellinen samankaltaisuus, ja tämä johtuu siitä, että monet välittäjät ja entsyymit ovat biosynteettisillä reiteillä.
Se voi palvella sinua: Flora ja Efauna de Salta: Edustavampi lajiL-valiinin biosynteesin aikana tuotettu ketoasidi säätelee joitain entsymaattisia vaiheita negatiivisen palautteen tai alosteisen säätelyn avulla leusiinin ja muiden siihen liittyvien aminohappojen biosynteettisellä reitillä.
Tämä tarkoittaa, että biosynteettiset reitit estävät niissä syntyneellä metaboliitilla, joka kerättynä antaa soluille spesifisen signaalin, joka kertoo heille, että tietty aminohappo on liiallisesti ja siksi sen synteesi voi lopettaa.
Heikkeneminen
Valiinin kolme ensimmäistä hajoamisvaihetta jaetaan kaikkien haarautuneiden ketjun aminohappojen hajoamisreittillä.
Valina voi päästä Krebs-sitruunahapposykliin transformoitavaksi sukkinyyli-CoA: ksi. Hajoamisreitti koostuu alkuperäisestä transaminaatiosta, jota katalysoidaan haarautuneiden ketjun aminohappojen (BCAT) aminotransferaasina tunnetulla entsyymillä (BCAT).
Tämä entsyymi katalysoi palautuvaa transaminaatiota, joka onnistuu muuttamaan haarautuneet ketjun aminohapot vastaaviksi haarautuneiksi ketjuiksi a-zo-stoatteiksi.
Tässä reaktiossa glutamaatin/2-zotoglutaraatin vääntömomentin osallistuminen on välttämätöntä, koska 2-zotoglutaraatti vastaanottaa aminohaposta poistetun aminohapon, joka metaboloituu ja muuttuu glutamaatiksi.
Tämä valiinin katabolismin ensimmäinen reaktiovaihe tuottaa 2-kethoisavalaatin ja siihen liittyy pyridoksaalisen 5'-fosfaatin (PLP) muuntaminen pyridoksamiinissa 5'-fosfaatissa (PMP) (PMP).
Sitten 2-kethoisvalaattia käytetään mitokondriaalisen entsymaattisen kompleksin substraattina, jota kutsutaan haarautuneen ketjun α-a-Zo-Stoattsiksi, joka lisää coash-osan ja muodostaa isobutiril-CoA: n, joka myöhemmin dehydrataan ja muutetaan metacrilililiksi ja muutetaan metacrilililiksi ja muutetaan metacrilililiksi ja muutetaan metacrilililiksi ja muutetaan metacrilililiksi ja muutetaan metacrilililiksi ja muutetaan metacrilililiksi ja muutetaan metacrilililiksi ja muutetaan metacrilililiksi ja muutetaan metacrilililiksi -Coa.
Metakryyli-CoA: n prosessoidaan alavirtaan viidessä ylimääräisessä entsymaattisessa vaiheessa, joihin sisältyy hydraatio, koosiosan eliminointi, hapettuminen, toisen koosiosan lisääminen ja molekyylin uudelleenjärjestely, joka päättyy sucnyyli-CoA: n tuotantoon, joka välittömästi Krebs-sykli.
Ruoat, joissa on rikas Valina
Seesamin tai seesaminsiementen sisältämät proteiinit ovat runsaasti Valina, lähes 60 mg aminohappoa jokaiselle proteiinin grammille. Tästä syystä evästeitä, keksejä ja seesamibaareja tai Nougatia suositellaan lapsille, joilla on puutteelliset ruokavaliot tämän aminohapon kanssa.
Soijajyvät ovat yleensä runsaasti kaikissa välttämättömissä aminohapoissa, jopa Valinassa. Ne ovat kuitenkin köyhiä metioniinissa ja kysteiinissä. Proteiinilla tai soijakuvioinnilla on erittäin monimutkaiset kvaternääriset rakenteet, mutta jotka on helppo liuottaa ja erottaa pienemmiksi alayksiköiksi mahalaukun mehujen läsnä ollessa.
Kaseiini, joka on tyypillisesti maidossa ja sen johdannaisissa, on runsaasti Valinan toistuvia sekvenssejä. Kuten soijapavut, tämä proteiini hajoaa helposti ja imeytyy nisäkkäiden suolistossa.
On arvioitu, että jokaisesta 100 grammasta soijaproteiinia varten nautitaan noin 4,9 grammaa; Jokaisen 100 ml: n maitoa varten noin 4,6 ml Valaa nautitaan.
Muita mainittua aminohappoa runsaat elintarvikkeet ovat naudanliha, kala ja erityyppiset vihannekset ja vihannekset.
Saannisi edut
Valine, kuten suuri osa aminohappoja, on glykogeeninen aminohappo, ts. Se voidaan sisällyttää glukoneogeeniseen reittiin, ja monet neurologit väittävät, että niiden saanti auttaa ylläpitämään mielenterveyttä, lihasten koordinointia ja vähentämään stressiä.
Voi palvella sinua: tärkeimmän bioteknologian 5 haaraaMonet urheilijat kuluttavat puristettua painetta Valinassa, koska ne auttavat kudosten, erityisesti lihaskudoksen uudistamista. Aminohappo, joka kykenee yhdistämään glukoneogeneesiä.
Valina -elintarvikkeet auttavat ylläpitämään typpiyhdisteiden tasapainoa kehossa. Tämä tasapaino on välttämätön energian tuottamiselle nautittujen proteiinien, kehon kasvun ja paranemisen kannalta.
Sen kulutus estää maksan ja sappirakon vaurioita sekä myötävaikuttaa monien kehon toimintojen optimointiin.
Yksi suosituimmista ravintolisistä urheilijoiden välillä lihaksen määrän ja lihaksen palautumisen lisäämiseksi on BCAA.
Tämäntyyppiset tabletit koostuvat tabletteista, joissa on seoksia erilaisista aminohapoista, joiden joukossa on yleensä aminohappoja, kuten L-valiini, L-isoleusiini ja L-Leucina; Ne ovat myös runsaasti B12 -vitamiinia ja muita vitamiineja.
Jotkut sikojen kokeet ovat osoittaneet, että seliinivaatimukset ovat paljon korkeammat ja rajoittavat äidit imetysvaiheen aikana, koska tämä aminohappo auttaa erittämään maitoa ja tuottaa parannuksia vastasyntyneiden vastasyntyneiden kasvunopeuteen.
Puutoshäiriöt
Pikkulapsille suositeltu päivittäinen valine -saanti on noin 35 mg kullekin käytetylle grammille, kun taas aikuisilla määrä on hiukan pienempi (noin 13 mg).
Yleisin valiniin ja muihin haarautuneisiin ketjun aminohappoihin liittyvä sairaus tunnetaan nimellä "virtsatauti arce -siirappilla" tai "ketoasiduria".
Tämä on perinnöllinen tila, joka johtuu geeneissä, jotka koodaavat leusiinista, isoleusiinista ja valiinista johdettujen a-Zo-happojen dehydrogeeniset entsyymit, jotka ovat välttämättömiä niiden metaboloimiseksi.
Tässä taudissa organismi ei voi rinnastaa mitään näistä kolmesta aminohapposta, kun ne saadaan ruokavaliosta, siksi johdetut ketoasidit kerääntyvät ja karkotetaan virtsaan (ne voidaan myös havaita veren seerumissa ja aivo -selkäydinnesteessä).
Toisaalta huono ruokavalio Valinassa on liittynyt neurologisiin patologioihin, kuten epilepsia. Se voi myös aiheuttaa painonpudotusta, Huntingtonin tautia ja voi jopa päätyä tietyntyyppisten syöpien kehittämiseen, koska kudoksen korjausjärjestelmä ja biomolekyylien synteesi vaarantuvat.
Viitteet
- Abu-Baker, S. (2015). Katsaus biokemiaan: Käsitteet ja yhteydet
- Nelson, D. Lens., Lehninger, a. Lens., & Cox, M. M. (2008). Lehninger -biokemian periaatteet. Macmillan.
- Plimmer, r. H. -Lla., & Phillips, H. (1924). Proteiinien analyysi. III. Histidiinin ja tyrosiinin arviointi pommituksella. Biochemical Journal, 18 (2), 312
- Plimmer, r. H. -Lla. (1912). Proteiinien kemiallinen perustuslaki (VOL. 1). Longmans, vihreä.
- Torii, k. -Lla. Z -z. TAI. JOMPIKUMPI., & Iitaka, ja. (1970). L-valinin kiderakenne. Crystallographica-osa B: Rakenteellinen kristallografia ja kidekemia, 26 (9), 1317-1326.
- Tosti, v., Bertozzi, b., & Fontana, L. (2017). Välimeren ruokavalion terveyshyödyt: aineenvaihdunta- ja molekyylimekanismit. Gerontologian lehdet: Sarja A, 73 (3), 318-326.
- « Gravitaatioenergiakaavat, ominaisuudet, sovellukset, harjoitukset
- 115 parasta ilmausta eleganssista »

