Haihtuvuus

- 4994
- 409
- Alonzo Kirlin
 Kun vettä lämmitetään levyllä, kunnes höyry tapahtuu, haihtuminen tapahtuu. Lisenssillä
Kun vettä lämmitetään levyllä, kunnes höyry tapahtuu, haihtuminen tapahtuu. Lisenssillä Mikä on haihtuvuus?
Se haihtuvuus Se on nesteen tai kiinteän tilan kemikaalin muuntamisprosessi kaasumaiseksi tai höyryksi. Muita termiä, joita käytetään saman prosessin kuvaamiseen, ovat höyrystyminen, tislaus ja sublimointi.
Aine voidaan usein erottaa toisesta haihtumalla, ja se voidaan talteen höyryn kondensaatiolla.
Aine voidaan haihduttaa nopeammin, joko lämmittämällä sitä höyrypaineen lisäämiseksi tai höyryttämällä inertti kaasuvirta tai tyhjiöpumppu.
Lämmitysmenetelmät sisältävät veden, elohopean tai arseenitrikloridin haihtumisen näiden aineiden erottamiseksi häiritsevistä elementeistä.
Joskus kemiallisia reaktioita käytetään haihtuvien tuotteiden tuottamiseen, kuten hiilidioksidin vapautumisessa karbonaateista, ammoniakki Kjeldahl -menetelmässä typen ja rikkidioksidin määrittämiseksi teräsrrin määrittämisessä.
Haihtumismenetelmille on yleensä ominaista suuri yksinkertaisuus ja käyttö helppous, paitsi silloin, kun korroosionkestävälle vastustuskykyinen tai tarvitaan materiaaleja.
Höyrynpaineen haihtuminen
Tietäen, että veden kiehumislämpötila on 100 ° C: ssa, on aiheellista kysyä, miksi sadevesi haihtuu. Jos se on 100 ° C: ssa, sen pitäisi antaa meille lämpöä.
On myös syytä kysyä, mitä ominainen tuoksu antaa alkoholille, etikalle, puulle tai muoville.
Kaikesta tästä vastuussa oleva henkilö on ominaisuus, joka tunnetaan nimellä höyrynpaine, joka on tasapainon höyryn kohdistama paine saman aineen kiinteän tai nestemäisen faasin kanssa. Myös aineen osittainen paine ilmakehässä kiinteässä tai nesteessä.
Höyrynpaine on mitattu materiaalin taipumus vaihdettavaksi kaasumaiseksi tai höyrytilaan, ts. Aineen volatiliteetin mittaus.
Se voi palvella sinua: Hiilidisulfidi (CS2): rakenne, ominaisuudet, käytöt, riskitHöyrynpaineen noustessa, sitä suurempi nesteen tai kiinteän aineen kapasiteetti haihtua, siten haihtuneempi.
Höyrynpaine nousee lämpötilan kanssa. Lämpötilaa, jossa nesteen pinnalla olevaa höyrynpaine.
Höyrynpaine riippuu liuennesta liuennesta liuokseen (se on kolgatiivinen ominaisuus). Liuoksen pinnalla (ilma-alhainen rajapinta) pinnallisimmilla molekyyleillä on taipumus haihtua, vaihtamalla vaiheiden välillä ja höyrypaineen tuottamisen välillä.
Liuenneen aineen läsnäolo vähentää liuotinmolekyylien lukumäärää rajapinnassa vähentäen höyrynpainetta.
Höyrynpaineen muutos voidaan laskea RAAULT: n laki ei haihduttamattomien liuenneiden aineiden suhteen, jotka annetaan:
(1)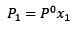 Jos P1 on höyrynpaine liuenneen aineen lisäämisen jälkeen, X1 on mainitun liuenneen aineen ja p °: n molaarinen fraktio on puhtaan liuottimen höyrypaine.
Jos P1 on höyrynpaine liuenneen aineen lisäämisen jälkeen, X1 on mainitun liuenneen aineen ja p °: n molaarinen fraktio on puhtaan liuottimen höyrypaine.
Jos liuenneen aineen ja liuottimen molaaristen fraktioiden summa on yhtä suuri kuin 1, meillä on:
(2)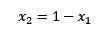
Missä x2 on liuottimen molaarinen fraktio. Jos kerrotaan yhtälön molemmat puolet p °: lla, se pysyy:
(3)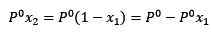
Korvaaminen (1) kohdassa (3) pysyy:
(4)
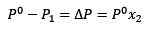
Tämä on höyrynpaineen vaihtelu, kun liuennettu aine liukenee.
Gravimetrinen analyysi
Gravimetrinen analyysi on laboratoriotekniikoiden luokka, jota käytetään aineen massan tai pitoisuuden määrittämiseen mittaamalla massamuutos.
Kemisti, jota yritämme kvantifioida, kutsutaan joskus analyytiksi. Voisimme käyttää gravimetristä analyysiä vastaamaan kysymyksiin, kuten:
Voi palvella sinua: metallimineraalit- Mikä on analyytin pitoisuus liuoksessa?
- Kuinka puhdas on näytteemme? Tässä oleva näyte voi olla kiinteä tai liuos.
Gravimetristä analyysiä on kahta yleistä tyyppiä. Molemmat sisältävät analyytin vaiheen muutoksen sen erottamiseksi muusta seoksesta, mikä johtaa taikinan muutokseen.
Yksi näistä menetelmistä on sademäärä gravimetria, mutta se, joka todella kiinnostaa meitä.
Haihtumisen gravimetria perustuu lämpö- tai kemiallisesti näytteeseen ja mittaa tuloksena oleva muutos sen massassa.
Vaihtoehtoisesti voimme saada kiinni ja punnita haihtuvan hajoamisen tuotteen. Koska haihtuvien lajien vapautuminen on olennainen osa näitä menetelmiä, luokittelemme ne yhdessä gravimetrisiksi haihtumisanalyysimenetelmiksi.
Gravimetriset analyysi -ongelmat ovat yksinkertaisesti stökiometria -ongelmia muutamalla lisävaiheella.
Kaikkien stökiometristen laskelmien suorittamiseksi tarvitsemme tasapainoisen kemiallisen yhtälön kertoimet.
Esimerkiksi, jos näyte sisältää dihydratoituneen bariumin epäpuhtauksia (BACL2● H₂o), voit saada näytteen lämmittävien epäpuhtauksien määrän veden haihduttamiseksi.
Alkuperäisen näytteen ja lämmitetyn näytteen välinen massaero antaa meille grammaa bariumkloridin sisältämän veden määrän.
Yksinkertaisella stökiometrisellä laskelmalla saadaan näytteen epäpuhtauksien määrä.
Jakotislaus
Jakeinen tislaus on prosessi, jolla nestemäisen seoksen komponentit erotetaan eri osiin (kutsutaan fraktioihin) niiden eri kiehumispisteiden mukaisesti.
Seoksen yhdisteiden volatiliteettierolla on perustavanlaatuinen rooli sen erottelussa.
Voi palvella sinua: Octet -sääntöKemikaalien puhdistamiseen ja myös seoksien erottamiseen ja komponenttien hankkimiseen käytetään murto -tislausta. Sitä käytetään laboratoriotekniikkana ja teollisuudessa, jossa prosessilla on suuri kaupallinen merkitys.
Kiehumisliuoksen höyryt ohitetaan korkeaa pylvästä, nimeltään alajako -sarake.
Pylväs on täynnä muovi- tai lasihelmiä erottamisen parantamiseksi, mikä tarjoaa enemmän pinta -alaa kondensoitumiseen ja haihtumiseen.
Pylvään lämpötila vähenee vähitellen sen pituudella. Komponentit, joilla on korkeampi kiehumispiste, tiivistetään pylväässä ja palautuvat liuokseen.
Alemmat kiehumispisteet (haihtuvat) kulkevat pylvään läpi ja kerätään lähellä.
Teoreettisesti lisää helmiä tai levyjä parantaa erottelua, mutta levyjen lisääminen lisää myös tislauksen suorittamiseen tarvittavaa aikaa ja energiaa.
Haihtuvuusesimerkit
- Kuiva jäälohko kosketuksessa ilma -purskeen kanssa. Ilma aloittaa haihtumisprosessin ja jää haihtuu: se kulkee kiinteästä tilasta soodaan.
- Kun vettä tai muuta ainetta keitetään: lämpö tuottaa höyryä ja siten vesi kulkee nestemäisestä tilasta kaasumaiseen.
- Nafthalin pillerit, jotka vähitellen hajoavat ja kulkevat kiinteästä tilasta soodalle.
- Kun kiinteä rikki on korkeita lämpötiloja, siitä tulee myrkyllisiä kaasuja. Eli se menee kiinteästä kaasumaiseksi.
- Aromatisoivat pillerit: Niillä on sama prosessi kuin naftaliinilääkkeet, vähitellen hajoavat ja muuttuvat kaasu, hajuista ja vaarattomia.
Viitteet
- Paineen määritelmä höyry. Toipunut Ajatelukyvystä.com.
- Höyryn paine. Toipunut Britannicasta.com.

