Berylliumoksidi (BEEO)
- 3419
- 592
- Gabriel Fahey
 Beryylioksidin kemiallinen rakenne
Beryylioksidin kemiallinen rakenne Mikä on berylioksidi?
Hän berylliumoksidi (BEEO) on keraaminen materiaali, jolla on korkean lujuuden ja sähkövastuksensa lisäksi niin korkea lämmönjohtavuuskyky, joka tekee osan ydinreaktorista, jopa ylittäen metallit tässä viimeisessä kiinteistössä.
Synteettisen materiaalin hyödyllisyyden lisäksi sitä löytyy myös luonnosta, vaikka se on harvinaista. Sen hallinta on suoritettava huolellisesti, koska sillä on kyky vahingoittaa vakavasti ihmisten terveyttä.
Nykymaailmassa on havaittu, kuinka teknologiayrityksiin liittyvät tutkijat ovat tehneet tutkimusta edistyneiden materiaalien kehittämiseksi melko erikoistuneille sovelluksille, kuten puolijohdemateriaalit ja ilmailu-.
Tämän tuloksena on ollut aineiden löytäminen, jotka ovat erittäin hyödyllisten ominaisuuksiensa ja korkean kestävyytensä ansiosta antaneet meille mahdollisuuden edetä ajan myötä, mikä antaa meille mahdollisuuden tuoda tekniikkamme korkeammalle tasolle korkealle tasolle.
Beryylioksidin kemiallinen rakenne
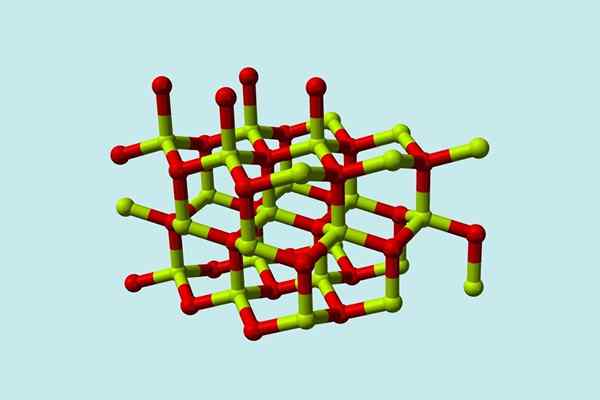
Beryylioksidimolekyyli (kutsutaan myös Berilia) Se koostuu berylliumin atomista ja yhdestä happea, molemmat koordinoituna tetraedriseen suuntautumiseen ja kiteytyy kuusikulmainen kiteisiin rakenteisiin, joita kutsutaan wurtzitasiksi.
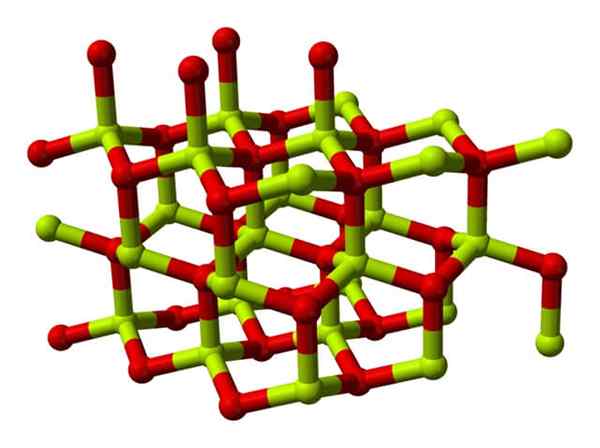 Beryylioksidin kiteisen rakenteen malli. Lähde: Wikimedia Commons
Beryylioksidin kiteisen rakenteen malli. Lähde: Wikimedia Commons Näillä kiteillä on tetraedrikeskuksia, jotka ovat miehittäneet2+ Minä2-. Korkeissa lämpötiloissa berylliumoksidin rakenteesta tulee tetragonaalinen tyyppi.
Beryylioksidin hankkiminen saavutetaan kolmella menetelmällä: beryylihiilen kalsinointi, beryylihydroksidin dehydraatio tai metallisen berylliumin sytytys. Korkeissa lämpötiloissa muodostettu berylliumoksidi on inertti, mutta se voidaan liuottaa useilla yhdisteillä.
Voi palvella sinua: klorogeenihappoBeco3 + Lämpö → Bee + Co2 (Kalsinointi)
Ole (Voi)2 → Beeo + H2O (kuivuminen)
2 olla + tai2 → 2 BEEO (sytytys)
Lopuksi berylliumoksidi voidaan höyrystää, ja tässä tilassa se esitetään diatomisten molekyylien muodossa.
Bamery -oksidiominaisuudet
Berylliumoksidia esitetään luonteeltaan bromellitana, valkoisena mineraalina, jota esiintyy joissakin monimutkaisissa mangaani-hydrero-kerrostumissa, mutta sitä esiintyy yleisemmin sen synteettisessä muodossa: valkoinen amorfinen kiinteä aine, jota esiintyy pölysmuodossa.
Myös tuotannon aikana loukkuun jääneet epäpuhtaudet antavat monipuolisia värejä oksidinäytteelle.
Sen sulatuspiste sijaitsee 2.507º C, sen kiehumispiste 3.900º C, ja sen tiheys on 3,01 g/cm3.
Samoin sen kemiallinen stabiilisuus on huomattavasti korkea, reagoi vain vesihöyryn kanssa lämpötiloissa lähellä 1.000º C ja kestää hiilen vähentämisprosesseja ja hyökkäyksiä sulaan metalleihin korkeissa lämpötiloissa.
Lisäksi sen mekaaninen vastus on kunnollinen, ja sitä voidaan parantaa malleilla ja riittävällä valmistuksella kaupallisiin käyttötarkoituksiin.
Sähkönjohtavuus
Berylliumoksidi on erittäin stabiili keraaminen materiaali, ja siksi sillä on melko korkea sähkövastus, joka tekee siitä yhden parhaimmista sähköeristäväistä materiaaleista yhdessä alumiinioksidin kanssa.
Tämän vuoksi sitä käytetään yleisesti korkeataajuuden erikoistuneisiin sähkölaitteisiin.
Lämmönjohtokyky
Beryllium -oksidilla on suuri etu sen lämmönjohtavuudessa: se tunnetaan toiseksi parhaaksi lämmönjohtavana materiaalina ei -metallien keskuudessa.
Voi palvella sinua: tiolesMetallien osalta vain kupari ja hopea siirrä lämpöä ajamalla kuin berylliumoksidi, mikä tekee siitä erittäin toivotun materiaalin.
Erinomaisten lämmönkäytön ominaisuuksien vuoksi tämä aine on ollut mukana tulenkestävän materiaalin tuotannossa.
Optiset ominaisuudet
Samojen kiteisten ominaisuuksien takia berylliumoksidia käytetään läpinäkyvän materiaalin levittämiseen ultravioletiksi tietyissä litteissä seuloissa ja aurinkosähkökennoissa.
Samoin voi esiintyä erittäin korkealaatuisia kiteitä, joten nämä ominaisuudet paranevat käytetyn valmistusprosessin mukaan.
Terveysriskit
Berylliumoksidi on yhdiste, jota on manipuloitava erittäin huolellisesti, koska sillä on ensin syöpää aiheuttavia ominaisuuksia, jotka on liitetty tämän materiaalin jatkuviin jauheisiin tai höyryihin.
Pienet hiukkaset näissä oksidin vaiheissa tarttuvat keuhkoihin ja voivat tuottaa kasvainten muodostumisen tai bellioosiksi kutsutun sairauden.
Berilaioosi on tauti, jonka keskitason kuolleisuus, joka tuottaa tehottomia hengitystä, yskää, painonpudotusta ja kuumetta, sekä granuloomien muodostuminen keuhkoihin tai muihin kärsineisiin elimiin.
Berylliumoksidin ohjaamiseksi ihon kanssa on myös vaaroja, koska se on syövyttävä ja ärsyttävä, ja se voi aiheuttaa vaurioita ihon pinnalle ja limakalvoille. Hengitystiet ja kädet tulisi suojata työskennellessäsi tämän materiaalin kanssa, etenkin niiden pölymuodossa.
Berylliumoksidi käyttää
Berylioksidin käyttö on jaettu pääasiassa kolmeen: elektroniset sovellukset, ydin ja muut.
Voi palvella sinua: mikä on virheeneo?Elektroniset sovellukset
Kyky siirtää lämpöä korkealle tasolle ja sen hyvä sähkövastus on saanut belerilioksidin hankkimaan suuren hyödyllisyyden lämpöhävittäjänä.
Sen käyttö piireissä korkean kapasiteetin tietokoneissa on todistettu, laitteiden lisäksi, jotka käsittelevät korkeaa sähkövirtaa.
Berylliumoksidi on läpinäkyvä x -säteilylle ja mikroaaltouunille, joten sitä käytetään Windowsissa tämäntyyppisiä säteilyä vastaan antennien, viestintäjärjestelmien ja mikroaaltouunien lisäksi.
Ydinsovellus
Sen kyky kohdistaa neutroneja ja ylläpitää niiden rakennetta säteilypommituksessa.
Muut sovellukset
Berylliumoksidin pieni tiheys on herättänyt kiinnostusta ilmailu- ja sotilasteknologiateollisuuteen, koska se voi edustaa matalapainoa rakettien ja antibalien liivin moottoreissa.
Lopuksi sitä on sovellettu äskettäin tulenkestävänä materiaalina metallurgisen teollisuuden fuusioon.
Viitteet
- Pubchem (S.F.-A. Berylliumoksidi. Saatu Pubchemista.NCBI.Nlm.NIH.Hallitus
- S (s.F.-A. Beryllia/berylliumoksidi (BEEO). Reade Reade.com
- Tutkimus, c. (S.F.-A. Berylliumoksidi - Beryllia. Saatu Azomista.com
- Palvelut, n. J -. (S.F.-A. Berylliumoksidi. Palautettu NJ: ltä.Hallitus
- Wikipedia (S.F.-A. Berylliumoksidi. Saatu.Wikipedia.org

