Boorioksidi (B2O3) Mikä on, rakenne, ominaisuudet, käyttää
- 2607
- 545
- Mr. Clifford Kshlerin
Hän boorioksidi o boorihydridi on epäorgaaninen yhdiste, jonka kemiallinen kaava on B2JOMPIKUMPI3. Koska boori- ja happea elementit ovat jaksollisen taulukon P -lohko P, ja vielä enemmän heidän ryhmiensä päätä, niiden välinen elektronegatiivisuuden ero ei ole kovin korkea; Siksi odotetaan, että b2JOMPIKUMPI3 olla luonteeltaan kovalenttinen.
B2JOMPIKUMPI3 Se valmistetaan liuottamalla booraksi väkevöityyn rikkihapossa sulautumisuunin sisään ja lämpötilassa 750ºC; Lämpö kuivuttava boorihappo, B (OH)3, lämpötilassa noin 300 ° C; tai se voidaan muodostaa myös diborano -reaktion tuotteena (B2H6) Hapen kanssa.
Boro -oksidilla voi olla puoliksi läpinäkyvä tai kiteinen lasinen ulkonäkö; Jälkimmäinen jauhamalla voidaan saada pölymuodossa.
Vaikka se ei näytä ensi silmäyksestä, B: tä otetaan huomioon2JOMPIKUMPI3 yhtenä monimutkaisimmista epäorgaanisista oksideista; Ei vain rakenteellisesta näkökulmasta, vaan myös muuttuvien ominaisuuksien vuoksi, jotka lasi ja keramiikka hankkivat, joihin ne lisätään heidän matriisiinsa.
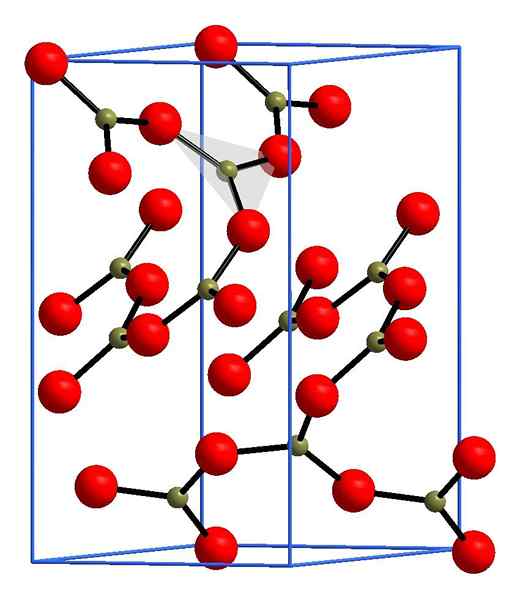
Boro -oksidirakenne
Yhtenäisyys bo3
B2JOMPIKUMPI3 Se on kovalenttinen kiinteä, joten teoriassa niitä ei ole sen ionin B -rakenteessa3+ ei myöskään2-, Mutta b-o linkit. Valencian linkkiteorian (TEV) mukaan boori voi muodostaa vain kolme kovalenttisia linkkejä; Tässä tapauksessa kolme B-O-linkkiä. Tämän seurauksena odotettavissa olevan geometrian on oltava trigonaalista, Bo3.
Bo -molekyyli3 Se on huonoja elektroneja, etenkin happiatomeja; Useat heistä voivat kuitenkin olla vuorovaikutuksessa toistensa kanssa mainittua puutetta. Siten kolmiot bo3 Niihin liittyy happisillan jakaminen, ja ne jakautuvat avaruuteen kolmionmuotoisina rivit verkot niiden tasoilla, jotka ovat suuntautuneita eri tavoin.
Voi palvella sinua: tyydyttymätön ratkaisuKiteinen rakenne
 Boro -oksidirakenne. Andif1, Wikimedia Commons.
Boro -oksidirakenne. Andif1, Wikimedia Commons. Yläkuvassa esimerkki näistä riveistä, joissa on kolmionmuotoiset yksiköt3. Jos sitä havaitaan huolellisesti, kaikki suunnitelmien kasvot eivät osoita lukijalle, vaan toiselle puolelle. Näiden kasvojen suuntaukset voivat olla vastuussa siitä, kuinka B määritetään2JOMPIKUMPI3 tietyssä lämpötilassa ja paineessa.
Kun näillä verkoilla on pitkä mittainen rakenteellinen kuvio, se on kiteinen kiinteä aine, joka voidaan rakentaa sen yksikkösolusta. Tässä sanotaan, että b2JOMPIKUMPI3 Siinä on kaksi kiteistä polymorfia: α ja β.
Α-B2JOMPIKUMPI3 Sitä tuotetaan ympäristön paineessa (1 atm), ja sanotaan, että se on kineettisesti epävakaa; Itse asiassa tämä on yksi syy siihen, miksi boorioksidi on todennäköisesti vaikea kiteytysyhdiste.
Toinen polymorfia, β-B2JOMPIKUMPI3, Korkeat paineet saadaan GPA -alueella; Siksi sen tiheyden on oltava suurempi kuin α-B2JOMPIKUMPI3.
Lasimainen rakenne
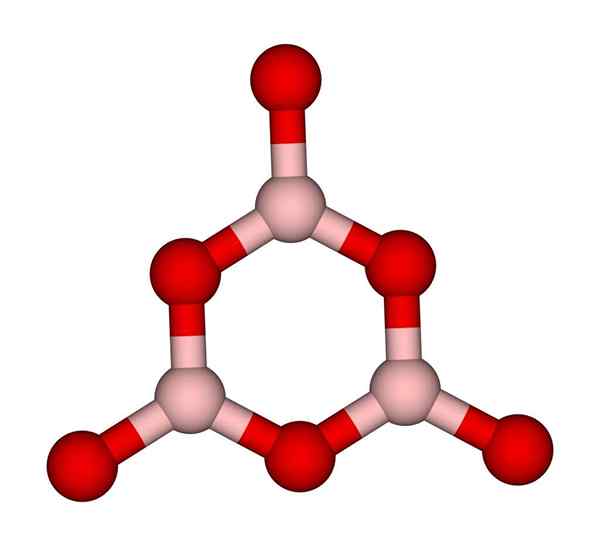 Boroksolirengas. Ccoil (puhu). Wikimedia Commons.
Boroksolirengas. Ccoil (puhu). Wikimedia Commons. Bo -verkot3 Luonnollisesti taipumus omaksua amorfiset rakenteet; Näistä puuttuu malli, joka kuvaa kiinteän molekyylejä tai ioneja. Syntetisoimalla b2JOMPIKUMPI3 Sen vallitseva muoto on amorfinen eikä kiteinen; Oikeasti sanoin: se on kiinteämpi lasimainen kuin kiteinen.
Sitten sanotaan, että b2JOMPIKUMPI3 Se on lasimainen tai amorfinen, kun Bo -pojat3 Ne ovat sotkuisia. Ei vain tämä, mutta myös muuttavat tapaa, jolla he liittyvät. Trigonaalisen geometrian tilaamisen sijasta boroksirengas (ylivoimainen kuva) päätyy tutkijoiden luomiseen (ylivoimainen kuva).
Voi palvella sinua: 20 esimerkkiä kemiallisesta energiastaHuomaa, että kolmionmuotoisten ja kuusikulmaisten yksiköiden välillä on selvä ero. Kolmionmuotoinen karakterisoi b2JOMPIKUMPI3 kiteinen ja kuusikulmainen b: lle2JOMPIKUMPI3 lasimainen. Toinen tapa viitata tähän amorfiseen vaiheeseen on boorilasi tai kaavan avulla: G-B2JOMPIKUMPI3 ('G' tulee sanasta Glassy, englanniksi).
Siten G-B-verkot2JOMPIKUMPI3 Ne koostuvat boroksolirenkaista eikä bo -yksiköistä3. G-B2JOMPIKUMPI3 voi kiteyttää α-B: ksi2JOMPIKUMPI3, joka tarkoittaisi renkaiden kääntämistä kolmioihin ja määrittelee myös saavutetun kiteytymisasteen.
Ominaisuudet
Fyysinen ulkonäkö
Se on väritön ja lasinen kiinteä. Kiteisessä muodossaan se on valkoinen.
Molekyylimassa
69 6182 g/mol.
Maku
Hieman katkera
Tiheys
-Kristalliini: 2,46 g/ml.
-Lasimainen: 1,80 g/ml.
Sulamispiste
Sillä ei ole täysin määriteltyä fuusiopistettä, koska se riippuu siitä, kuinka kiteinen tai lasimainen se on. Puhtaasti kiteinen muoto sulaa 450ºC: seen; Lasimainen muoto kuitenkin sulaa lämpötila -alueelle, joka kattaa välillä 300 - 700ºC.
Kiehumispiste
Jälleen ilmoitetut arvot eivät vastaa tätä arvoa. Ilmeisesti nestemäinen boorioksidi (sula sen kiteistä tai lasista) kiehuu 1860ºC: n lämpötilassa.
Vakaus
Se on pidettävä kuivana, koska se imee kosteuden muuttuakseen boorihapona, b (OH)3.
Nimikkeistö
Boro -oksidi voidaan nimetä muilla tavoilla, kuten:
-Diboro -trioksidi (systemaattinen nimikkeistö).
-Boorioksidi (III) (varastossa nimikkeistö).
-Boorioksidi (perinteinen nimikkeistö).
Sovellukset
Jotkut boorioksidin käytöstä ovat:
Boro trihalogenuros -synteesi
B: stä2JOMPIKUMPI3 voidaan syntetisoida trihalogenuros de Boro, BX3 (X = f, cl y br). Nämä yhdisteet ovat Lewis -happoja, ja niiden kanssa on mahdollista tuoda booriatomit tietyille molekyyleille muiden johdannaisten saamiseksi, joilla on uusia ominaisuuksia.
Se voi palvella sinua: Polyiatomit -ionit: Lista ja harjoituksetHyönteismyrkky
Kiinteä seos boorihapolla, B2JOMPIKUMPI3-B (OH)3, edustaa kaavaa, jota käytetään kotimaan hyönteismyrkkynä.
Metallioksidien liuotin: lasinmuodostus, keramiikka ja booriseokset
Nestemäinen boorioksidi kykenee liuottamaan metallioksideja. Tästä tuloksena olevasta seoksesta, kun se on jäähdytetty, saadaan kiintoaineet, jotka koostuvat boorista ja metalleista.
B: n määrästä riippuen2JOMPIKUMPI3 Käytetään, samoin kuin tekniikka ja metallioksidin tyyppi, rikas valikoima lasia (borosilikaatit), keramiikka (nitridit ja boorikarbidit), ja seoksia voidaan saada (jos vain metalleja käytetään).
Yleensä lasi tai keramiikka saa suuremman vastus- ja voiman ja myös suuremman kestävyyden. Lasin tapauksessa niitä käytetään optisiin ja kaukoputken linsseihin ja elektronisiin laitteisiin.
Sideaine
Teräsvalimouunien rakentamisessa käytetään tulenkestäviä tiilejä, joissa on magnesiumia. Heissä boorioksidia käytetään sideaineena, auttaen pitämään ne voimakkaasti yhtenäisinä.
Viitteet
- Boorioksidi. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Borix -oksidi. 20 Mule Team Borax. Palautettu: Borax.com

