Tinoksidi (II) rakenne, ominaisuudet, nimikkeistö, käyttää

- 1350
- 95
- Eddie Hackett
Hän tinoksidi (II) Se on kiteinen epäorgaaninen kiinteä aine, joka muodostuu hapettua happea happea, missä Tin hankkii Valencia 2+. Sen kemiallinen kaava on SNO. Tämän yhdisteen kaksi eri tapaa tunnetaan: musta ja punainen. Yleinen ja vakain muoto huoneenlämpötilassa on musta tai mustansininen modifikaatio.
Tämä muoto valmistetaan tinakloridihydrolyysillä (II) (SNCL2) Vesiliuokseen, johon lisätään ammoniumhydroksidi (NH4OH) saada hydratoidun oksidin sakka SN (II), jonka kaava on SNO.XH2Tai missä x<1 (x menor que 1).
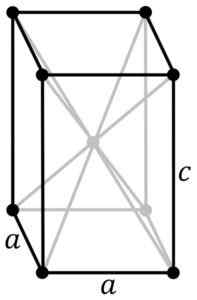 Mustansinisen SNO: n tetragonaalinen kiteinen rakenne. SN -atomi sijaitsee rakenteen keskellä ja happiatomeja rinnakkaiskipien kärjissä. Käyttäjän alkuperäiset PNG: t: Rocha, jäljitetty käyttäjän maisemiin: Stannered [CC BY-SA 3.0 (http: // creativecommons.Org/lisenssit/by-SA/3.0/]] Lähde: Wikipedia Commons
Mustansinisen SNO: n tetragonaalinen kiteinen rakenne. SN -atomi sijaitsee rakenteen keskellä ja happiatomeja rinnakkaiskipien kärjissä. Käyttäjän alkuperäiset PNG: t: Rocha, jäljitetty käyttäjän maisemiin: Stannered [CC BY-SA 3.0 (http: // creativecommons.Org/lisenssit/by-SA/3.0/]] Lähde: Wikipedia Commons Hydratoitu oksidi on valkoinen amorfinen kiinteä aine, joka kuumennetaan sitten suspensiona 60-70 ºC: seen useita tunteja NH: n läsnä ollessa4Voi, kunnes saat mustan kiteisen puhtaan SNO: n.
SNO: n punainen muoto on metastabiilinen. Se voidaan valmistaa lisäämällä fosforihappo (H3Poikki4) - 22% fosforihapolla, H3Poikki3 - Ja sitten NH4Voi SNCL -liuos2. Saatu valkoinen kiinteä aine kuumennetaan samassa liuoksessa 90-100 ºC: seen noin 10 minuutin ajan. Tällä tavoin saadaan puhdas punainen kiteinen sno.
Tinoksidi (II) on lähtöaine muiden tinayhdisteiden (II) tuottamiseksi (II). Tästä syystä se on yksi tinayhdisteistä, joilla on huomattava kaupallinen merkitys.
Tinoksidi (II) on alhainen toksisuus kuten useimmissa tina -indorgaanisissa yhdisteissä. Tämä johtuu heidän huonosta imeytymisestä ja elävien olentojen nopeasta erittymisestä.
Se voi palvella sinua: Bip Beraral: Mikä on, ominaisuudet, mitä se onEsittelee yhden suurimmista tinayhdisteiden toleransseista rotilla suoritetuissa testeissä. Se voi kuitenkin olla haitallista, jos sitä hengitetään suurina määrinä.
[TOC]
Rakenne
Tinoksidi (ii) mustansininen
Tämä modifikaatio kiteytyy tetragonaalisella rakenteella. Siinä on kerrosjärjestely.
Muut tutkijat vakuuttavat, että jokaista SN -atomia ympäröi 5 happiatomia, jotka ovat suunnilleen oktaedron kärkipisteissä, joissa kuudennen kärjen on oletettavasti vapaa tai ei -parilla olevia elektroneja. Tätä kutsutaan φ-oktiseksi järjestelyksi.
Punainen tinoksidi (II)
Tämä tinoksidin muoto (II) kiteytyy ortorromisella rakenteella.
Nimikkeistö
- Tinoksidi (II)
- Estany -oksidi
- Tina -monoksidi
- Estany -oksidi
Ominaisuudet
Fyysinen tila
Kiteinen kiinteä.
Molekyylipaino
134,71 g/mol.
Sulamispiste
1080 ºC. Se hajoaa.
Tiheys
6,45 g/cm3
Liukoisuus
Liukenematon kylmään tai kuumaan veteen. Liukenematon metanoliin, mutta se liukenee nopeasti happoihin ja konsentroituneisiin emäksisiin.
Muut ominaisuudet
Jos yli 300 ºC kuumennetaan ilman läsnä ollessa, tinoksidi (II) hapettuu nopeasti tinoksidissa (IV), joka aiheuttaa hehkulamppuja.
On raportoitu, että ei-oksidantteissa olosuhteissa tinoksidin (II) lämmitys on erilaisia tuloksia lähtöoksidin puhtauden asteen mukaan. Se on yleensä suhteettomia metallisessa SN- ja Tin -oksidissa (IV), SNO: ssa2, Erilaisten välilajien kanssa, joista lopulta tulee sno2.
Tinaoksidi (II) on amfotero, koska se on liuennut happoihin SN -ionien antamiseksi2+ tai anionit kompleksit ja liukenee myös alkaliin hydroksi-stantti-ioniliuosten muodostamiseksi, SN (OH)3-, joilla on pyramidaalinen rakenne.
Se voi palvella sinua: perkloorihappo: kaava, ominaisuudet ja käytötLisäksi SNO on pelkistävä aine ja reagoi nopeasti orgaanisten happojen ja mineraalien kanssa.
Se aiheuttaa alhaisen toksisuuden verrattuna muihin tinasuoloihin. Sen DL50 (50% tappava annos tai keskimääräinen tappava annos) rotilla on yli 10000 mg/kg. Tämä tarkoittaa, että yli 10 grammaa kiloa kohti tarvitaan 50%: n rotan näytteiden tappamiseksi tietyn koejakson aikana. Vertailun vuoksi tinafluoridi (II) esittelee 188 mg/kg DL50.
Kuitenkin, jos sitä hengitetään pitkään, se kerrostuu keuhkoihin, koska se ei imeytyy ja voi tuottaa tinaa (SNO -pölyn tunkeutuminen keuhkojen väliintuloihin).
Sovellukset
Muiden tinayhdisteiden (II) tuotannossa (II)
Sen nopea reaktio happojen kanssa on sen tärkeimmän käytön perusta, joka on välittäjä muiden tinayhdisteiden valmistuksessa.
Sitä käytetään tinabromidin (II) tuotannossa (SNBR2), Tinisyanidi (II) (SN (CN)2) ja tina -fluoroboraattihydraatti (II) (SN (BF4-A2), Muun muassa tinayhdisteet (ii).
Tinafluorobaatti (II) valmistetaan liuottamalla snom. Tämä johtuu muun muassa sen korkeasta kattavuuskapasiteetista.
Tina (II) oksidia käytetään myös tinasulfaattivalmistuksessa (II) (SNSO4), SNO- ja rikkihapporeaktio, H2Sw4.
SNSO4 Saatu, sitä käytetään tinatussa prosessissa painetun piirilevyjen tuottamiseksi, sähkökontaktin viimeistelyyn ja keittiövälineisiin.
Voi palvella sinua: alumiinikarbonaatti: rakenne, ominaisuudet, käyttötarkoitukset Tulostettu piiri. Ei konetta luettavissa olevaa kirjailijaa. Abraham del Pozo oletettiin (perustuen tekijänoikeusvaatimuksiin). [Julkinen verkkotunnus] Lähde: Wikimedia Commons
Tulostettu piiri. Ei konetta luettavissa olevaa kirjailijaa. Abraham del Pozo oletettiin (perustuen tekijänoikeusvaatimuksiin). [Julkinen verkkotunnus] Lähde: Wikimedia Commons SNO: n hydratoitu muoto, tina hydrotado (II) SNO.XH2Tai sitä käsitellään fluoriahorhahapolla tinafluoridin (II), SNF: n saamiseksi2, joka lisätään dentifric -voiteisiin agenttina kariesin torjumiseksi.
Koruissa
Tinaoksidia (II) käytetään kulta-iskujen ja kuparikiteiden valmistuksessa. Ilmeisesti sen tehtävä tässä sovelluksessa on toimia pelkistävänä aineena.
 Jalokivi. Lähde: Pixabay
Jalokivi. Lähde: Pixabay Muut käyttötarkoitukset
Sitä on käytetty aurinkosähkölaitteissa sähkön tuottamiseksi valosta, kuten aurinkokennot.
 Aurinkosähkölaite. Georg Slickers [CC BY-SA 2.5 (https: // creativecommons.Org/lisenssit/by-SA/2.5)] Lähde: Wikipedia Commons
Aurinkosähkölaite. Georg Slickers [CC BY-SA 2.5 (https: // creativecommons.Org/lisenssit/by-SA/2.5)] Lähde: Wikipedia Commons Viimeaikaiset innovaatiot
Hiilinanoputkien elektrodeissa litium-sokeriakkuja on käytetty SNO-järjestettyjä nanohiukkasia.
 Sno -hydraattien nanokuitu. Fionán [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Lähde: Wikipedia Commons
Sno -hydraattien nanokuitu. Fionán [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Lähde: Wikipedia Commons SNO -valmistetut elektrodit osoittavat suurta johtavuutta ja pieniä volyymin muutoksia toistuvissa lastaus- ja latausjaksoissa.
Lisäksi SNO helpottaa nopeaa ionin/elektroninsiirtoa hapettumisen vähentämisreaktioiden aikana, jotka tapahtuvat tällaisessa akkujärjestelmässä.
Viitteet
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.
- Tanssi, j.C.; Emeléus, H.J -.; Sir Ronald Nyholm ja Trotman-Deckenson,.F. (1973). Kattava epäorgaaninen kemia. Nide 2. Pergamon Press.
- Ullmannin teollisuuskemian tietosanakirja. (1990). Viides painos. Volume A27. Vch verlagsgellschaft mbh.
- Kirk-Othmer (1994). Kemiallisen tekniikan tietosanakirja. Osa 24. Neljäs painos. John Wiley & Sons.
- Ostrakhovitch, Elena. Ja cherian, m. George. (2007). Tina. Metallien toksikologian käsikirjassa. Kolmas painos. ScienEdirect.com.
- Kwestroo, w. ja vromanit, P.H.G.M. (1967). Kolme puhtaan tinan (II) oksidin modifikaatiota. J -. Inorg. Nukl. Kemia., 1967, vol.29, s.2187-2190.
- S.S et ai. (1992). Stansonoksisten oksidioksidikalvojen optiset ominaisuudet. Tšekkoslovak Journal of Physics. Helmikuu 1992, osa 42, numero 2. Springeriltä palautettu.com.
- A-young Kim et ai. (2017). Tilotut SNO-nanohiukkaset MWCNT: ssä toiminnallisena isäntämateriaalina korkean korkoisen litium-rikkipariston katodille. Nano Research 2017, 10 (6). Springeriltä palautettu.com.
- Lääketieteen kansalliskirjasto. (2019). Stanssioksidi. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- « Jacquard kangashistoria, operaatio, käyttää
- Funktionalismi (arkkitehtuuri) historia, ominaisuudet, teokset »

