Strontiumoksidi (SRO) rakenne, ominaisuudet, sovellukset
- 4108
- 1167
- Alonzo Kirlin
Selitämme, mikä strontiumioksidi, sen kemiallinen rakenne, fysikaaliset ja kemialliset ominaisuudet, sovellukset ja riskit ovat
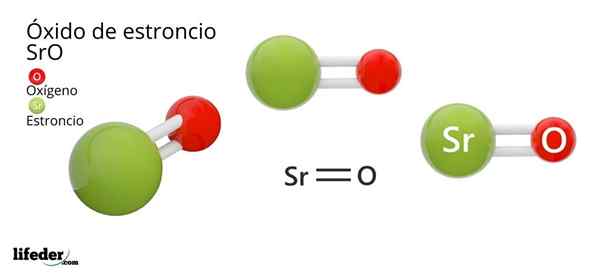
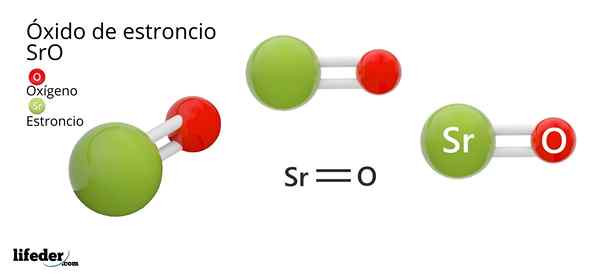
Hän Strontiumioksidi, jonka kemiallinen kaava on SRO (ei pidä sekoittaa strontiumperoksidiin, joka on SRO2), on tämän metallin ja ilmassa olevan hapen välisen hapettumisreaktion tuote huoneenlämpötilassa: 2SR (s) + O2 (g) → 2Sro (t).
Pala strontium palaa kosketuksessa ilman kanssa sen korkean reaktiivisuuden seurauksena, ja koska sillä on NS2 -tyypin elektroninen konfiguraatio, sen kaksi valenssielektronia tuottaa helposti, etenkin diatomisen happimolekyylin.
Jos metallin pinta -alaa täydennetään suihkuttamalla sitä, kunnes sillä on hienosti jaettu jauhe, reaktio tapahtuu välittömästi ja jopa polttaa voimakkaalla punertavalla liekillä. Strontium, metalli, joka osallistuu tähän reaktioon, on jaksollisen taulukon ryhmän 2 metalli.
Tämä ryhmä koostuu alkalista tunnetuista elementeistä. Ensimmäinen ryhmän johtamista elementeistä on beryllium, jota seuraavat magnesium, kalsium, strontium, barium ja lopuksi radio. Nämä elementit ovat luonteeltaan metallia, ja niiden muistetaan muistosääntö, ilmaisua voidaan käyttää: “SR. Becambara ".
"MR", johon lauseke viittaa Sen suolat, nitridit ja oksidit.
Tästä syystä mineraalit ja strontiumioksidi ovat yhdisteitä, joissa strontiumia löytyy luonnosta.
[TOC]
Strontiumoksidin fysikaaliset ja kemialliset ominaisuudet
 Strontiumoksidin fyysinen ulkonäkö
Strontiumoksidin fyysinen ulkonäkö Strontiumoksidi on kiinteä valkoinen, huokoinen ja wc -yhdiste, ja sen fyysisestä käsittelystä riippuen löytyy markkinoilta hienona pölynä, kuten kiteinä tai nanohiukkasina.
Voi palvella sinua: oksiditSen molekyylipaino on 103 619 g/mol ja sillä on korkea taitekerroin. Siinä on fuusiopisteitä (2531 ºC) ja kiehuminen (3200 ° C), mikä tarkoittaa vahvoja linkkien vuorovaikutuksia strontiumin ja hapen välillä. Tämä korkea sulamispiste tekee siitä lämpövakaan materiaalin.
Perusoksidi
Se on erittäin emäksinen oksidi; Tämä tarkoittaa, että se reagoi huoneenlämpötilassa veden kanssa strontiumhydroksidin (SR (OH) 2) muodostamiseksi:
SRO (S) + H2O (L) → SR (OH) 2
Liukoisuus
Se myös reagoi tai säilyttää kosteuden, olennainen ominaisuus hygroskooppisille yhdisteille. Siksi strontiumoksidilla on korkea reaktiivisuus veden kanssa.
Muissa liuottimissa - esimerkiksi alkoholit, kuten apteekin etanoli tai metanoli - ovat liukenevia; Vaikka liuottimissa, kuten asetoni, eetteri tai dikloorimetaani, se on liukenematon.
Miksi se on tällainen? Koska metallioksidit -ja vielä enemmän ne, jotka muodostuvat alkalinottimista metalleista -ovat polaarisia yhdisteitä ja ovat siksi vuorovaikutuksessa polaaristen liuottimien kanssa.
Se ei vain reagoida veden kanssa, vaan myös hiilidioksidilla, tuottaen strontiumkarbonaattia:
SRO (S) + CO2 (G) → SRCO3 (s)
Se reagoi happojen kanssa - kuten esimerkiksi laimennettu fosforihappo - suola- ja vesifosfaattisuolan tuottamiseksi:
3Sro (s) + 2 H3PO4 (DIL) → SR3 (PO4) 2 (S) + 3H2O (G)
Nämä reaktiot ovat eksotermisiä, minkä vuoksi tuotettu vesi haihtuu korkeilla lämpötiloilla.
Kemiallinen rakenne
Yhdisteen kemiallinen rakenne selittää, millaiset sen atomit ovat avaruudessa. Strontiumoksidin tapauksessa se sisältää jalokiviä suolatyyppisen kiteisen rakenteen, saman taulukon suolan tai natriumkloridin (NaCl).
Voi palvella sinua: kalsiumbikarbonaattiToisin kuin NaCl, monovalenttisuola -toisin sanoen kationilla ja anionilla, joiden suuruus on (+1 NA: lle ja -1: lle CL: lle) -, SRO on kaksiarvoinen, 2+ -kuormituksen kanssa SR: lle ja -2: lle. O (O2-, oksidianioni).
Tässä rakenteessa jokaista O2- (punainen) ionia ympäröi kuusi muuta tilaa vievää oksidia, jotka isännöivät sen tuloksena olevia oktaedrisia väliintuneita SR2+ -ioneja (vihreä väri), pienempiä. Tämä pakkaus tai järjestely tunnetaan kuutiometriä yhtenäisinä soluina, jotka on keskittynyt kasvoihin (CCC).
Linkkityyppi
Strontiumioksidin kemiallinen kaava on SRO, mutta ei ehdottomasti selitä kemiallista rakennetta tai olemassa olevaa linkkityyppiä.
Edellisessä osassa mainittiin, että se on GEMA -suolarakenne; toisin sanoen hyvin yleinen kiteinen rakenne monille suoloille.
Siksi linkin tyyppi on pääosin ioninen, mikä selventäisi, miksi tällä oksidilla on korkea fuusio- ja kiehumispisteet.
Koska linkki on ioninen, strontiumin ja hapen atomit ovat sähköstaattiset vuorovaikutukset yhdessä: Sr2+ O2-.
Jos tämä sidos olisi kovalenttinen, yhdistettä voitaisiin edustaa linkillä sen Lewis -rakenteessa (jättämättä jaettuja happielektroneja).
Sovellukset
Yhdisteen fysikaaliset ominaisuudet ovat välttämättömiä ennustamaan, mitkä niiden mahdolliset sovellukset teollisuudessa olisivat; Siksi nämä ovat makro heijastus sen kemiallisista ominaisuuksista.
Pääkorvike
Strontiumoksidi korkean lämpöstabiilisuutensa ansiosta löytyy monia sovelluksia keraamisessa, lasi- ja optiikkateollisuudessa.
Sen käyttö näillä toimialoilla on pääasiassa korvata lyijy ja olla lisäaine, joka antaa parempia värejä ja viskositeetteja tuotteiden raaka -aineeseen.
Voi palvella sinua: vuokraa halogeenuros: ominaisuudet, hankkiminen, esimerkkejäMitkä tuotteet? Luettelossa ei olisi loppua, koska jossain niistä, joissa on lasi, emalit, keramiikka tai kiteet yhdessä sen kappaleessa, strontiumioksidi voi olla hyödyllinen.
Ilmailu-
Koska se on erittäin huokoinen kiinteä kiinteä, se voi internerisoida pienempiä hiukkasia ja tarjoaa siten valikoiman mahdollisuuksia materiaalien formulaatiossa, kuten ilmailu-.
Katalyytti
Sama huokoisuus antaa sinulle mahdolliset käytöt katalyyttinä (kemiallisten reaktioiden kiihdytin) ja lämmönvaihtimena.
Elektroniset tarkoitukset
Strontiumoksidi toimii myös puhtaan strbanin tuotannon lähteenä elektronisiin tarkoituksiin tämän metallin kyvyn imeämisen imeämisen vuoksi; Ja sen hydroksidin, SR (OH) 2: n ja sen peroksidin, SRO2: n teollisen valmistelun kannalta, SRO2.
Terveysriskit
Se on syövyttävä yhdiste, joten se voi aiheuttaa palovammoja yksinkertaisella fysikaalisella kosketuksella missä tahansa kehossa. Se on erittäin herkkä kosteudelle ja se on säilytettävä kuiviin ja kylmiin tiloihin.
Tämän oksidin reaktion suolatuote eri happojen kanssa käyttäytyy kehossa samoin kuin kalsiumsuolat, ja ne varastoidaan tai karkotetaan samanlaisilla mekanismeilla.
Tuolloin strontiumioksidi sinänsä ei edusta suurempia terveysriskejä.
Viitteet
- Amerikkalaiset elementit. (1998-2018). Amerikkalaiset elementit. Toipunut amerikkalaisista.com
- Shiver & Atkins. (2008). Epäorgaaninen kemia. Yksinkertaisten kiinteiden aineiden rakenteissa (neljäs ED., p. 84). MC Graw Hill.
- Atsdr. Palautettu ASDR: stä: ATSDR.CDC.Hallitus
- Clark, J. (2009). Kemina. Kemguidesta palautettu.yhteistyö.Yhdistynyt kuningaskunta
- Tiwary, r., Narayan, s., & Pandey tai. (2007). Sontoniumoksidin valmistus Celestite: A Review. Materiaalitiede, 201-211.

