Fosforioksidi (V) rakenne, ominaisuudet, hankkiminen, käyttö, riskit

- 2058
- 348
- Shawn Stanton II
Hän Fosforioksidi (V) Se on epäorgaaninen kiinteä kiinteä kiinteä kiinteä aine, jonka muodostaa fosfori (P) ja happi (O). Sen empiirinen kaava on P2JOMPIKUMPI5, Vaikka sen oikea molekyyl kaava on P4JOMPIKUMPI10. Se on erittäin hygroskooppinen valkoinen kiinteä aine, ts. Se voi absorboida ilmaa ilmasta erittäin helposti, reagoi heti tämän kanssa. Reaktio voi olla vaarallinen, koska se aiheuttaa nopeaa lämpötilan nousua.
Sen korkea taipumus absorboida vettä on aiheuttanut sen käyttämisen kuivausaineena kemiallisissa laboratorioissa, samoin kuin kuivua joitain yhdisteitä, ts. Veden poistamiseksi sen molekyyleistä.
 Fosforioksidi (V) -jauhe, P4JOMPIKUMPI10. LHCHEM [CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons.
Fosforioksidi (V) -jauhe, P4JOMPIKUMPI10. LHCHEM [CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons. Fosforioksidia (V) käytetään myös erilaisten hiilivetyjen molekyylien sitoutumisreaktioiden kiihdyttämiseen, koska se on kondensaatio, jota kutsutaan kondensaatioksi. Lisäksi se mahdollistaa tiettyjen orgaanisten happojen muuntamisen estereiksi.
Sitä on käytetty esimerkiksi bensiinin hienosäätöön, fosforihapon H valmistamiseksi3Poikki4, Yhdisteiden saamiseksi, jotka viivyttävät tulta, lasin valmistukseen tyhjiösovelluksiin, monien muiden käyttötarkoituksien joukossa.
Fosforioksidi (V) tulisi pitää hyvin suljetuissa astioissa, jotta estetään kosketus kosteuden kanssa ilmasta. Se on syövyttävää ja voi vahingoittaa silmiä, ihoa ja limakalvoa.
[TOC]
Rakenne
Fosforioksidi (V) muodostuu fosforia (P) ja happea (O), jossa fosforin valenssi on +5 ja happi -2. Fosforioksidimolekyylissä (V) on neljä fosforia ja kymmenen happiatomia, ja siksi sen oikea molekyyl kaava on P on P4JOMPIKUMPI10.
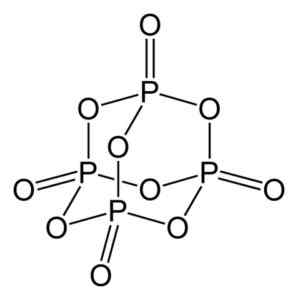 Fosforioksidimolekyylin rakenne (V), P4JOMPIKUMPI10. Kirjoittaja: Benjah-BMM27. Lähde: Wikimedia Commons.
Fosforioksidimolekyylin rakenne (V), P4JOMPIKUMPI10. Kirjoittaja: Benjah-BMM27. Lähde: Wikimedia Commons. Esiintyy kolmessa kiteisessä muodossa, kuten amorfinen pöly ja lasimuotoisessa muodossa (kuten lasi). Kuusikulmaisessa kiteisessä muodossa jokainen fosforiatomeista löytyy tetraedron kärkipisteistä.
Nimikkeistö
- Fosforioksidi (V)
- Fosforipentoksidi
- Pentoksidi
Voi palvella sinua: Liuotin: Konsepti, tyypit ja esimerkit- Fosforipentoksidi
- Fosforihanhydridi
- Tetrafosforin rappeutuminen
Ominaisuudet
Fyysinen tila
Kiteinen valkoinen kiinteä aine. Yleisin muoto on kuusikulmainen kiteitä.
Molekyylipaino
283,89 g/mol
Sulamispiste
562 ºC
Sublimaatiolämpötila
360 ºC - 1 paine ilmakehän. Se tarkoittaa, että tässä lämpötilassa kulkee kaasu -kiinteistöstä menemättä nestemäisen tilan läpi.
Tiheys
2,30 g/cm3
Liukoisuus
Hyvin liukeneminen veteen. Rikkihappo. Liukenematon asetoniin ja ammoniakkiin.
Kemialliset ominaisuudet
Fosforioksidi (V) absorboi ja reagoi ilman kanssa ilmasta äärimmäisen fosforihapon H kanssa3Poikki4. Tämä reaktio on eksoterminen, mikä tarkoittaa, että lämpöä syntyy saman aikana.
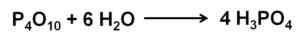 Fosfori (V) -oksidireaktio veden kanssa fosforihappo H: n muodostamiseksi3Poikki4. Kirjoittaja: Marilú Stea.
Fosfori (V) -oksidireaktio veden kanssa fosforihappo H: n muodostamiseksi3Poikki4. Kirjoittaja: Marilú Stea. P: n reaktio4JOMPIKUMPI10 vedellä johtaa fosforihappojen seoksen muodostumiseen, joiden koostumus riippuu veden määrästä ja olosuhteista.
Reaktio alkoholien kanssa johtaa fosforihapon tai polymeerihappoesterien muodostumiseen kokeellisista olosuhteista riippuen.
P4JOMPIKUMPI10 + 6 ROH → 2 (RO)2Poikki.Voi + 2 ro.PO (Voi)2
Emäksisten oksidien kanssa muodostavat kiinteät fosfaatit.
Se on syövyttävää. Se voi reagoida vaarallisesti muurahaishappo- ja epäorgaanisten emäksien, kuten natriumhydroksidin (NaOH), kalsiumoksidin (CAO) tai natriumkarbonaatin NA: n kanssa2Yhteistyö3.
Jos HCLO perklorihappoliuos kaadetaan4 ja chcl -kloroformi3 Fosforioksidissa (V) P4JOMPIKUMPI10 Väkivaltainen räjähdys tapahtuu.
Muut ominaisuudet
Se ei ole syttyvä. Ei suosittele palamista. Sen vesireaktio on kuitenkin niin väkivaltainen ja eksoterminen, että paloharkkisi voi olla.
Saada
Se voidaan valmistaa suoran fosforin hapettumisella kuivana ilmavirrassa. Fosfori, kun happea ylimääräinen kosketus hapettuu muodostaen fosforioksidia (V).
P4 + 5 o2 → P4JOMPIKUMPI10
Läsnäolo luonnossa
Fosforioksidia (V) löytyy mineraaleista, kuten Ilmeniitti, Rutilo ja Zircón.
Voi palvella sinua: Mitkä ovat epäorgaaniset kemialliset toiminnot?Ilmeniitti on mineraali, joka sisältää rautaa ja titaania ja jolla on joskus fosforin (V) oksidia pitoisuuksissa, jotka vaihtelevat välillä 0,04 - 0,33% painon mukaan. Rutilo on titaanioksidin mineraali ja voi sisältää noin 0,02% P: n painon mukaan2JOMPIKUMPI5.
Zircón-hiekka (zirkonium-elementti mineraali) on fosfori (V) -oksidi 0,05-0,39% painon mukaan.
Sovellukset
Kuivuvana ja sekoittajana
Vesien suuren aviditeetin vuoksi se on yksi tunnetuimmista ja erittäin tehokkaista kuivumisaineista alle 100 ° C: n lämpötiloissa.
Voi uuttaa vettä aineista, joita pidetään kuivausaineina. Voit esimerkiksi poistaa vettä rikkihaposta H2Sw4 tehdä siitä niin3 ja typpihappo HNO3 muuttamalla se n2JOMPIKUMPI5.
 Fosforioksidista (V) johtuva rikkihapon kuivuminen rikkihappojen kuivuminen. Kirjoittaja: Marilú Stea.
Fosforioksidista (V) johtuva rikkihapon kuivuminen rikkihappojen kuivuminen. Kirjoittaja: Marilú Stea. Pohjimmiltaan se voi kuivata kaikki nesteet ja kaasut, joiden kanssa se ei reagoi, joten se mahdollistaa kosteusjäljen poistamisen tyhjiöjärjestelmistä.
Orgaanisessa kemian reaktioissa
Fosforioksidi (V) tarjoaa orgaanisen yhdisteen renkaat ja muut kondensaatioreaktiot.
Se mahdollistaa orgaanisten happojen sterioinnin mahdollisuuden erottaa primaariset alifaattiset karboksyylihappot (hiilihapotetut ketjut ilman renkaita yhdessä -cOH -ryhmän kanssa toisessa päässä) ja aromaattiset hapot (ryhmä -COH, joka on kytketty bentseenirenkaan), kuten jälkimmäiset eivät reagoi.
Se myös eliminoi H -molekyylin2Tai amidas r (c = o) nh2 Ja se tekee niistä nitriles R-CN. Lisäksi katalysoi tai kiihdyttää bitumireaktioiden hapettumista, dehydraamista ja polymerointia.
 P4JOMPIKUMPI10 Sitä käytetään laajasti orgaanisissa kemian laboratorioissa. Kirjoittaja: JDN2001CN0. Lähde: Pixabay.
P4JOMPIKUMPI10 Sitä käytetään laajasti orgaanisissa kemian laboratorioissa. Kirjoittaja: JDN2001CN0. Lähde: Pixabay. Polttoaineen jalostamisessa
1930 -luvulta lähtien tietyt tutkimukset osoittivat, että fosforin (V) oksidi aiheutti kaasun puhdistamista, mikä lisäsi sen oktaania.
P: n puhdistustoiminta4JOMPIKUMPI10 Se johtuu pääasiassa kondensaatioreaktioista (eri molekyylien liitto) eikä polymeroinnista (yhtäläisten molekyylien sitoutuminen).
Voi palvella sinua: Natriumasetaatti: rakenne, ominaisuudet, synteesi, käyttöP4JOMPIKUMPI10 Kiihdyttää suoria alomaattisia hiilivetyjä olefiinihiilivetyillä, olefiinin muuntaminen teollisuusbensiiniksi ja osittaiseksi polymeroinniksi. Alkylointireaktio lisää bensiinin oktaania.
Tällä tavoin saadaan korkealaatuinen puhdistettu bensiini.
 Joitakin öljyjohdannaisia voidaan parantaa P: n vaikutuksella4JOMPIKUMPI10 Sen molekyyleissä. Kirjoittaja: drpeperscott230. Lähde: Pixabay.
Joitakin öljyjohdannaisia voidaan parantaa P: n vaikutuksella4JOMPIKUMPI10 Sen molekyyleissä. Kirjoittaja: drpeperscott230. Lähde: Pixabay. Erilaisissa sovelluksissa
Fosforioksidi (V) palvelee:
- Valmista fosforihappo H3Poikki4
- Hanki akrylaatti- ja pinta -aktiiviset esterit
- Valmista fosfaattiestereitä, joita käytetään liekin hidastimina, liuottimina ja laimesijina
- Fosforitrikloridimuuntaminen fosforioksikloridiksi
- Laboratorioreagenssi
- Valmista erikoislasit tyhjiöputkille
- Lisää asfaltin sulamispistettä
- Toimi standardi molekyylinä fosforin tai fosfaattien määrittämisessä fosfaattisissa kallioissa, lannoitteissa ja Portland -sementissä, P: n muodossa2JOMPIKUMPI5
- Paranna tiettyjen polymeerien ja norsunluukerroksen välisiä yhteyksiä
 Joidenkin erityislasien, kuten tyhjiöputkien, on käytettävä p: tä4JOMPIKUMPI10 valmistuksensa aikana. Tvezymer [julkinen alue]. Lähde: Wikimedia Commons.
Joidenkin erityislasien, kuten tyhjiöputkien, on käytettävä p: tä4JOMPIKUMPI10 valmistuksensa aikana. Tvezymer [julkinen alue]. Lähde: Wikimedia Commons. Riskejä
Fosforioksidia (V) on pidettävä suljettuissa astioissa ja tuoreissa, kuivissa ja hyvin tuuletuissa paikoissa.
Tämä estää sitä, ettei se kosketa vettä, koska se voi reagoida väkivaltaisesti sen kanssa, tuottaen erittäin lämpöä, palavia materiaaleja, jotka ovat palavia.
Fosforioksidi (V) -pöly on ärsyttävä silmä ja hengitystie ja syövyttävät iholle. Se voi tuottaa palovammoja silmissä. Nielemällä aiheuttavat kohtalokkaat sisäiset palovammat.
Viitteet
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Fosforihanhydridi. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Nayler, P. (2001). Bitumens: muokattu. Kemiallinen muutos. Materiaalien tietosanakirja: Tiede ja tekniikka. ScienEdirect.com.
- Malishev, b.W -. (1936). Fosforipentoksidi puhdistusaineena bensiinille. Teollisuus- ja tekniikan kemia 1936, 28, 2, 190-193. Pubista toipunut.ACS.org.
- Epps, Jr. JA.-Lla. (1950). Käytettävissä olevan fosforipentoksidin fotometrinen määritys fertlisaattoreissa. Analyyttinen kemia 1950, 22, 8, 1062-1063. Pubista toipunut.ACS.org.
- Banerjee, a. et al. (1983). Fosforipentoksidin käyttö: orgaanisten happojen esteröinti. J -. Org. Kemia. 1983, 48, 3108-3109. Pubista toipunut.ACS.org.
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.
- Kirk-Othmer (1994). Kemiallisen tekniikan tietosanakirja. Neljäs painos. John Wiley & Sons.
- Ogliari, f.-Lla. et al. (2008). Fosfaattimonomeerien synteesi ja sidonta dentiiniin: esteröintimenetelmät ja fosforipentoksidin käyttö. Journal of Dentistry, osa 36, numero 3, maaliskuu 2008, sivut 171-177. ScienEdirect.com.
- « Alumiiniasetaatti (Al (CH3CO) 3) rakenne, ominaisuudet, käyttää
- Merkinnät kehittivät esimerkkejä ja harjoituksia »

