Litiumoksidi
- 5011
- 453
- Shawn Stanton II
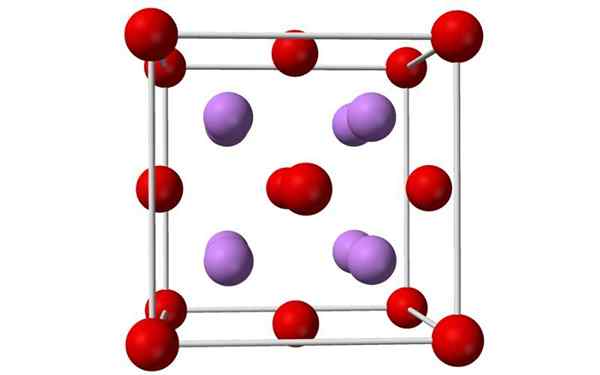
 Yhtenäisen litiumoksidisolun pallot ja palkkien malli. Lähde: Benjah-BMM27, Wikimedia Commons
Yhtenäisen litiumoksidisolun pallot ja palkkien malli. Lähde: Benjah-BMM27, Wikimedia Commons Mikä on litiumoksidi?
Hän Litiumoksidi Se on epäorgaaninen kaavan kemiallinen yhdiste LI2Tai se on muodostettu yhdessä pienten määrien litiumperoksidia, kun litiummetalli poltetaan ilmassa ja yhdistyvät happea.
90 -luvulle saakka metalli- ja litiummarkkinoita hallitsi Yhdysvaltain tuotanto mineraaliesiintymistä, mutta 2000 -luvun alussa suurin osa tuotannosta johdettiin muista lähteistä: Australia, Chile ja Portugali olivat tärkeimmät toimittajat maailmassa. Bolivialla on puolet litiumkerrostumista maailmassa, mutta se ei ole hieno tuottaja.
Tärkein kaupallinen muoto on litiumkarbonaatti, Li2Yhteistyö3, tuotettu mineraaleista tai salmuelasista useiden eri prosessien avulla.
Kun litium palaa ilmassa, päätuote on valkoinen litiumoksidioksidi, Li2JOMPIKUMPI. Lisäksi tapahtuu jonkin verran litiumperoksidia, Li2JOMPIKUMPI2, Myös valkoinen.
Se voidaan tehdä myös litiumhydroksidin, LOOH: n tai litiumperoksidin, LI: n, lämpöhajoamisen kautta2JOMPIKUMPI2.
4li (s) + o2(g) → 2li2Sinä)
2lioh (s) + lämpö → Li2Tai (s) + h₂o (g)
2li2JOMPIKUMPI2(s) + lämpö → 2li2Tai (s) + tai2(g)
Fysikaaliset ja kemialliset ominaisuudet
- Litiumoksidi on valkoinen kiinteä aine, joka tunnetaan nimellä Lithia, josta puuttuu aromi ja jolla on suolainen maku.
- Litiumoksidi ovat kiteitä, joilla on antifloriittigeometria, samanlaisia kuin natriumkloridi (kuutio keskittynyt kasvoihin).
- Sen molekyylipaino on 29,88 g/mol, sen tiheys on 2 013 g/ml ja fuusio- ja kiehumispisteet ovat vastaavasti 1438 ° C ja 2066 ° C.
Se voi palvella sinua: Epid- Yhdiste on hyvin liukoinen veteen, alkoholiin, eetteriin, pyridiiniin ja nitrobentseeniin.
- Litiumoksidi reagoi helposti vesihöyryn kanssa hydroksidin ja hiilidioksidin muodostamiseksi karbonaatin muodostamiseksi; Siksi sitä on säilytettävä ja hoidettava puhtaassa ja kuivassa ilmapiirissä.
- Oksidiyhdisteet eivät johda sähköä. Tietyt Perovskitan jäsennellyt oksidit ovat kuitenkin elektronisia johtavia, jotka löytävät levityksen kiinteän oksidin polttokennokatodissa ja hapen muodostumisjärjestelmissä.
- Ne ovat yhdisteitä, jotka sisältävät ainakin yhden happea anionin ja metallisen kationin.
Riskejä
Litiumoksidi on stabiili yhdiste, joka on yhteensopimaton vahvojen happojen, veden ja hiilidioksidin kanssa. Sikäli kuin tiedämme, litiumoksidin kemiallisia, fysikaalisia ja toksikologisia ominaisuuksia ei ole tutkittu ja raportoitu perusteellisesti.
Litiumyhdisteiden toksisuus on niiden liukoisuuden funktio veteen. Litiumionilla on myrkyllisyyttä keskushermostossa. Yhdiste on erittäin syövyttävä, ärsyttävä, jos se joutuu kosketuksiin silmien ja ihon kanssa, kun hengitetään tai nautitaan.
Silmäkontaktin tapauksessa sinun on tarkistettava, käytetäänkö piilolinssejä ja poista ne välittömästi. Ne on huuhdeltava juoksevalla vedellä vähintään 15 minuutin ajan pitämällä silmäluomet auki. Kylmää vettä voidaan käyttää, eikä silmävoidetta.
Jos kemikaali joutuu kosketuksiin vaatteiden kanssa, pidä se mahdollisimman nopeasti, suojaamalla omia käsiä ja vartaloaan. Aseta uhri turvasuihkun alle.
Jos kemikaali kertyy uhrin paljaaseen ihoon, kuten kädet, juoksevalla vedellä ja ei -kiireellisellä saippualla saastunut iho pestään pehmeästi ja varovasti. Kylmää vettä voidaan käyttää. Jos ärsytys jatkuu, hakea lääkärinhoitoa. Pese saastuneita vaatteita ennen kuin käytät sitä uudelleen.
Voi palvella sinua: Rankine -asteikko: Mikä on, tulokset, esimerkitHengityksen tapauksessa uhrin tulisi antaa seistä hyvin tuuletetulla alueella. Jos hengitys on vakava, uhri on evakuoitava turvalliselle alueelle mahdollisimman pian.
Löysää tiukkoja vaatteita, kuten paidan kaulat, vyöt tai solmio. Jos uhria on vaikea hengittää, happi on annettava. Jos uhri ei hengitä, suuhun suuhun elvytys tehdään.
Aina ottaen huomioon, että se voi olla vaarallista henkilölle, joka tarjoaa apua suuhun suuhun, kun hengitetty materiaali on myrkyllistä, tarttuvaa tai syövyttävää. Kaikissa tapauksissa olisi pyydettävä välitöntä lääketieteellistä hoitoa.
Sovellukset
- Litiumoksidia käytetään perustajana keraamisissa emaloissa, ja se luo sinistä kuparia ja ruusuja koboltilla. Reagoi veden ja höyryn kanssa muodostaen litiumhydroksidin, ja ne tulisi eristää niistä.
- Litiumoksidi (Li2O), jolla on korkea tritiopotentiaali, se on houkutteleva ehdokas DT -fuusioenergialaitoksen kiinteälle viljelymateriaalille, johtuen sen litiumiatomien suuresta tiheydestä (verrattu.
Li2O Se altistuu korkeille lämpötiloille neutronisäteilyllä fuusiohuovien käytön aikana. Näissä olosuhteissa LI: ssä syntyy suuri joukko säteilytysvirheitä2Tai, kuten heliumin aiheuttama turvotus, suhteellisen korkea lämmönlaajennus, viljan kasvu, lyh (t) muodostuminen ja sademäärä alhaisissa lämpötiloissa ja lioH (t) -massan kuljetus korkeissa lämpötiloissa.
Lisäksi Li2Tai joutuu jännitteisiin, jotka johtuvat LI: n lämpölaajennuseroista2O ja rakennemateriaalit. Nämä LI: n ominaisuudet2Tai johtaa haastaviin tekniikan ongelmiin sekä valmistuksessa että Manta -suunnittelussa.
Voi palvella sinua: Strontium -hydridi (SRH2)- Mahdollinen uusi käyttö on kuin koboltti- ja litiumoksidi, kuten katodi litium -ion -paristoissa, joita käytetään elektronisten matkapuhelinlaitteiden lisäämiseen kannettaviin tietokoneisiin, samoin kuin akkujen autoja.
Viitteet
- Amerikkalaiset elementit. Litiumoksidi. Toipunut amerikkalaisista amerikkalaisista.com.
- Litiumoksidi. Epimetallien palautuneita espimetaaleista.com.
- Litiumoksidi (LI2O). Ferp toipui.UCSD.Edu Ferp.UCSD.Edu.

