Kaliumoksidi (K2O)
- 3071
- 520
- Arthur Terry II
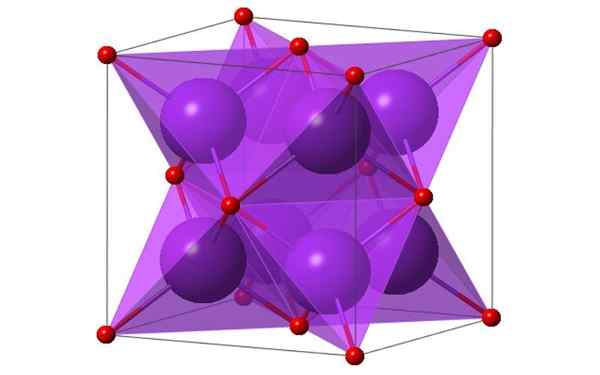
 4 kaliumoksidin molekyylin kuutiometriä. Lähde: Ktlabe, Wikimedia Commons
4 kaliumoksidin molekyylin kuutiometriä. Lähde: Ktlabe, Wikimedia Commons Mikä on kaliumoksidi?
Hän kaliumoksidi, Se on myös dipotasiumoksidi, se on ioninen happi ja kaliumsuola, kaava K2JOMPIKUMPI. Se on yksinkertaisin kaliumoksidi, erittäin reaktiivinen ja harvoin löydetty. Jotkut kauppamateriaalit, kuten lannoitteet ja sementti2JOMPIKUMPI.
Kaliumoksidia tuotetaan kaliumhydroksidista (kaustinen posaa) ja 450 ° C: n metallisesta kaliumista, mikä tuottaa molekyylin vetyä yhtälön mukaan:
2K + 2KOH ⇌ 2K2Tai + h2 (450 ° C).
Se saadaan myös vähentämällä kaliumperoksidia reaktion mukaan:
2K2JOMPIKUMPI2 → K2Tai + o2 (530 ° C).
Toinen kaliumoksidin saamismenetelmä on kuumentamalla kaliumkarbonaatti korkeassa lämpötilassa, kuten seuraavalla reaktiolla on merkitty:
K -k -2Yhteistyö3 ⇌ K2O + co₂ (t> 1200 ° C).
Tärkein tapa saada kaliumoksidia on kuitenkin kaliumnitraatin kuumentaminen, saadaan molekyylin typpi seuraavalla reaktiolla osoittamalla:
2KNO3 + 10K → 6K2Tai + n2
Fysikaaliset ja kemialliset ominaisuudet
- Ne ovat tetraedrisia kiteitä, kellertäviä, ilman ominaisia aromia.
- Sen molekyylipaino on 94,2 g/mol ja tiheys 2,13 g/ml 24 ° C: ssa.
- Sillä on 740 ° C: n sulamispiste, vaikka se alkaa hajottaa 300 ° C: ssa.
- Se on lämmönkestävä ja liukoinen etanoliin ja eetteriin. K -k -2Tai kiteytyy antifluoriitin rakenteessa. Tästä syystä anionien ja kationien asemat sijoitetaan suhteessa heidän kantaansa CAF: ssä2, koordinoiduilla kaliumioneilla 4 ioniin oksidi- ja oksidi -ioneja koordinoituna 8 kaliumissa.
- Se on emäksinen oksidi ja reagoi veden kanssa väkivaltaisesti kaustisen kaliumhydroksidin tuottamiseksi. Se on herkkua ja imee vettä ilmakehästä, aloittaen tämän voimakkaan reaktion.
Se voi palvella sinua: kalsiumnitraatti (CA (NO3) 2)- Se hapettaa palautuvasti kaliumperoksidiin 350 ° C: ssa, reagoi väkivaltaisesti happojen, kuten suolahappo, kanssa kaliumsuolojen muodostamiseksi reaktion mukaan:
K -k -2O + 2HCL → 2KCl + H₂O.
- Reagoi typpidioksidin kanssa nitraatin ja kaliumnitriitin muodostamiseksi lämpötiloissa välillä 150 - 200 ° C:
K -k -2O + 2no2 = Kno2 + Kno3
- Reagoi alhaisissa lämpötiloissa ammoniakin kanssa muodostaakseen Amidas ja kaliumhydroksidi reaktion mukaan:
K -k -2O + NH3 (L) → knh2↓ + KOH (-50 ° C).
Riskejä
Kaliumoksidi on epävakaa aine. Hapettaa helposti muita kalium-, peroksidi- tai kaliumhappo -oksideja (KHO). Yhdiste ei ole polttoainetta, mutta se reagoi voimakkaasti ja eksotermisesti veden kanssa kaliumhydroksidin (KOH) muodostamiseksi.
Kaliumoksidiliuos vedessä on vahva emäs, reagoi väkivaltaisesti hapon kanssa ja on syövyttävä. Reagoi väkivaltaisesti veden kanssa, joka tuottaa kaliumhydroksidia. Hyökkää monia metalleja veden läsnäollessa.
Aine on syövyttävä silmille, iholle ja hengitysteille, samoin kuin nauttimisella. Aerosolin hengittäminen voi aiheuttaa keuhkoödeeman, jonka oireet ilmenevät usein muutaman tunnin kuluttua, ja niitä pahentaa fyysinen ponnistus.
Silmäkontaktin tapauksessa sinun on tarkistettava, käytetäänkö piilolinssejä ja poista ne välittömästi. Silmät tulee pestä juoksevalla vedellä vähintään 15 minuutin ajan, avoimilla silmäluomilla. Kylmää vettä voidaan käyttää, eikä silmävoidetta.
Jos kemikaali joutuu kosketuksiin vaatteiden kanssa, pidä se mahdollisimman nopeasti, suojaamalla omia käsiä ja vartaloaan. Aseta uhri turvasuihkun alle.
Jos kemikaali kerääntyy paljaan ihon, kuten kädet, iho, joka on saastunut juoksevalla vedellä ja ei -kiehuvalla saippualla, pestään pehmeästi ja huolellisesti. Kylmää vettä voidaan käyttää. Jos ärsytys jatkuu, hakea lääkärinhoitoa. Pese saastuneita vaatteita ennen kuin käytät sitä uudelleen.
Se voi palvella sinua: Rubidio: historia, ominaisuudet, rakenne, hankkiminen, käyttöJos ihokosketus on vakava, se tulisi pestä desinfiointiaineisella saippualla ja peittää antibakteerisella kermalla saastunut iho.
Hengityksen tapauksessa uhrin tulisi antaa seistä hyvin tuuletetulla alueella. Jos hengitys on vakava, uhri on evakuoitava turvalliselle alueelle mahdollisimman pian.
Löysää tiukkoja vaatteita, kuten paidan kaulat, vyöt tai solmio. Jos uhria on vaikea hengittää, happi on annettava. Jos uhri ei hengitä, suuhun suuhun elvytys tehdään.
Aina ottaen huomioon, että se voi olla vaarallista henkilölle, joka tarjoaa apua suuhun suuhun, kun hengitetty materiaali on myrkyllistä, tarttuvaa tai syövyttävää.
Nielemisen tapauksessa se ei aiheuta oksentelua. Löysää tiukkoja vaatteita. Kaikissa tapauksissa olisi pyydettävä välitöntä lääketieteellistä hoitoa.
Sovellukset
- Kemiallinen kaava K2Tai (tai yksinkertaisesti k) käytetään useissa teollisissa yhteyksissä: N-P-K-numerot lannoitteille, sementtikaavoille ja lasi kaavoille.
Sitä ei usein käytetä suoraan näissä tuotteissa, mutta kaliumin määrä ilmoitetaan K -ekvivalentin suhteen2Tai minkä tahansa käytettyjen kaliumyhdisteiden, kuten kaliumkarbonaatti.
- Kaliumoksidi on noin 83% kaliumia, kun taas kaliumkloridi on vain 52%. Kaliumkloridi tarjoaa vähemmän kaliumia kuin yhtä suuri määrä kaliumoksidia.
Siksi, jos lannoite on 30% kaliumkloridia painon mukaan, sen standardi kaliumin indeksi, joka perustuu kaliumoksidiin, olisi vain 18,8%. Se on valmistettu ja/tai 10–100 tonnia vuodessa tästä aineesta Euroopan taloustilassa.
Voi palvella sinua: Kemia jokapäiväisessä elämässä: +30 esimerkkejä- . K2O Sillä on teollisuuskäyttö, joka johtaa toisen aineen valmistukseen (välituotteiden käyttö).
- Kaliumoksidia käytetään seoksen ja/tai maatalouden, metsätalouden ja kalastusformulaation alueilla. Sitä käytetään kemikaalien, muovituotteiden ja mineraalituotteiden valmistukseen (esimerkiksi kipsi, sementti).
- Sitä käytetään ulkona pitkän aikavälin materiaaleissa, joissa on vähän nopeutta vapauttamista, esimerkiksi metalli-, puu- ja muovimateriaalit.
- Sisustus-, pitkäaikaisia materiaaleja käytetään alhaisen vapauden nopeudella, kuten huonekalut, lelut, rakennusmateriaalit, verhot, jalkineet, nahkatuotteet, paperi- ja pahvituotteet, elektroniset laitteet.
- Tätä ainetta löytyy tuotteista, joilla.
- Kaliumoksidi on termisesti stabiili, erittäin liukenematon lähde, joka sopii lasi-, optisiin ja keraamisiin sovelluksiin. Oksidiyhdisteet eivät johda sähköä.
- Sitä käytetään myös kevyissä rakenteellisissa komponenteissa ilmailu- ja sähkökemiallisissa sovelluksissa, kuten polttoaineparistoissa, joissa ionisen johtavuuden näytteet.
Viitteet
- Amerikkalaiset elementit (S.F.-A. Kaliumoksidi. Toipunut amerikkalaisista.com.
- Dipassiumoksidi. Toiputettu ECHA: lta.Eurooppa.EU.

