Ei -metalliset oksidit

- 4193
- 322
- Gustavo Runte DVM
 Hiilidioksidi on kasvihuonekaasu ja on myös ei -metallista oksidia
Hiilidioksidi on kasvihuonekaasu ja on myös ei -metallista oksidia Mitkä ovat ei -metalliset oksidit?
Se ei -metalliset oksidit Ne ovat binaarisia yhdisteitä, jotka on muodostettu ei -metallisella positiivisella hapetustilan ja hapen välillä hapetustilassa -2. Näillä yhdisteillä kutsutaan myös hyydridejä ja happosoksideja, jotka yleensä muodostavat happoliliuoksia liuottamalla ne veteen, ja taipumus myös reagoida emäksisten oksidien kanssa oksisuolojen muodostamiseksi.
Ei -metallioksidit ovat luonteeltaan hyvin yleisiä. Itse asiassa niitä on kaikkialla. Vesi, elintärkeä neste, joka kattaa kaksi kolmasosaa maan pinnasta, on ei -metallista oksidia. Niin ovat hiilidioksidi, jota hengitämme hengityksen ja rikosoksidien aikana, jotka saastuttavat ilmaa ja jotka aiheuttavat happoa sadetta.
Muodostuvat ei -metallit ja happi (joka on myös ei -metalli), niiden atomien yhdistävät linkit ovat kovalenttisia sidoksia, useimmissa napa -tapauksissa. Tästä syystä suurimmalla osalla ei -metallisista tai anhydridioksidista on huomattavasti alhaiset kiehumispisteet, ja monet niistä ovat kaasuja huoneenlämpötilassa.
Ei -metalliset oksidioksidit
- Heillä ei ole kiiltoa tai metallista kiiltoa.
- Heillä voi olla eri värejä.
- Niiden atomeja yhdistyvät kovalenttisten joukkovelkakirjojen avulla ionisten linkkien sijasta.
- Ne muodostuvat happea ja ei -metallia.
- Metallioksideihin verrattuna niillä on yleensä alhainen sulamis- ja kiehumispisteet, vaikkakin hyvin monipuoliset.
- Useimmat ovat kaasuja, mutta niitä löytyy myös kiinteästä tilasta (kuten n2JOMPIKUMPI3) tai neste huoneenlämpötilassa.
- Kiinteät ei -metalliset oksidit ovat yleensä hauraita ja niiden kovuus voi olla erilainen.
- Ne ovat huonoja lämmön ja sähkön johtimia.
- Kun ne liukenevat veteen, ne reagoivat muodostamaan oksasidihappoja.
- Jotkut sen oksasidihapoista ovat vahvoja hapoja, jotka yleensä muodostavat anionit tai oksyanionit vesiliuoksessa.
- Ne reagoivat emäksisten oksidien kanssa oksisuolojen muodostamiseksi.
Ei -metallioksidien tyypit
Ei -metallisista oksidista ei ole muodollista tai yleisesti hyväksyttyä luokitusta. Ne voidaan kuitenkin ryhmitellä niiden happo-emäsominaisuuksien mukaan.
Vaikka ei -metallisia oksideja kutsutaan myös happioksideiksi, kaikki ne eivät aina reagoi happoina muita yhdisteitä vastaan. Tämän vuoksi kolme erityyppistä ei -metallista oksidia voidaan tunnistaa niiden happo/emäsominaisuuksien mukaan:
Ei -metallihapon oksidit
Ne ovat yleisimpiä. Valta.
- Joitakin happosioksidien esimerkkejä ovat typpihydridi (n2JOMPIKUMPI5) ja rikkihappoanhydridi (niin3-A.
Neutraalit ei -metalliset oksidit
Jotkut ei -metalliset oksidit eivät reagoi veteen ollenkaan liukeneessaan siihen. Näissä tapauksissa tuloksena oleva liuos on neutraali (se ei ole hapan eikä emäksinen).
- Joitakin esimerkkejä neutraaleista oksideista ovat hiilimonoksidi (CO), typpioksidi (N₂O) ja klooridioksidi (CLO2-A.
Ei -metalliset amfoturoriset oksidit
Termi Anfótero Se viittaa kemiallisen yhdisteen kykyyn käyttäytyä happona tai emäksenä riippuen siitä, kuka reagoi. Toisin sanoen nämä ovat yhdisteitä, jotka ovat sekä happoja että emäksiä samanaikaisesti.
- Amfoottisten ei -metallisten oksidien joukossa yleisin on vesi (H2JOMPIKUMPI). Vesi on amfotoninen, koska se pystyy antamaan protonin emäkselle (toimiva happona), mutta se pystyy myös vastaanottamaan happoa (toimivat emäksenä).
Esimerkkejä ei -metallisista oksideista
Kunkin ei -metallin yleisimmät ei -metalliset oksidit on esitetty alla, yhdessä sen molekyylikaavan kanssa, sen nimi IUPAC: n systemaattisen nimikkeistön mukaan, osakekannan nimikkeistön mukaan ja perinteisen nimikkeistön mukaan:
Hiilioksidit
Kaava | IUPAC -systemaattinen nimi | Nimikkeistö | Perinteinen nimi |
Yhteistyö | Hiilimonoksidi | Hiilioksidi (II) | Hiilihappoanhydridi |
Hiilidioksidi | Hiilidioksidi | Hiilioksidi (IV) | Hiilihydridi |
Typpioksidit
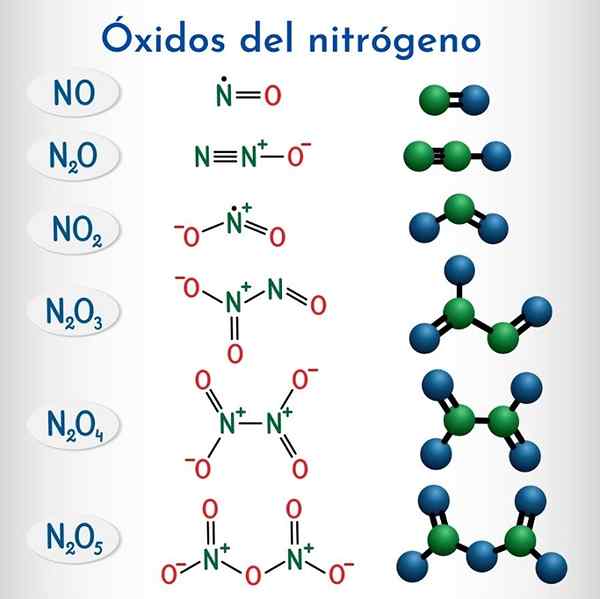 Kuuden ei -metallisen typpioksidin kaavat ja rakenteet
Kuuden ei -metallisen typpioksidin kaavat ja rakenteet Kaava | IUPAC -systemaattinen nimi | Nimikkeistö | Perinteinen nimi |
N2o | Dinitppimonoksidi | Typpioksidi (i) | Typpioksidi (Hiponitroso -anhydridi) |
EI | Typpimonoksidi | Typpioksidi (II) | Typpioksidi |
N2O3 | Dinitppitrioksidi | Typpioksidi (III) | Typpihydridi |
N2O4 | Dinitppitetraksidi | Typpioksidi (IV) | Typen tetraksidi |
NO2 | Typpidioksidi | Typpioksidi (IV) | Typpidioksidi |
N2O5 | Dinitppi pentaoksidi | Typpioksidi (V) | Typpihydridi |
Fosforioksidit
Kaava | IUPAC -systemaattinen nimi | Nimikkeistö | Perinteinen nimi |
P2O3 | Difosfosointitrioksidi | Fosforioksidi (III) | Fosforihydridi |
P2O5 | Pentaoksidi | Fosforioksidi (V) | Fosforihanhydridi |
P2O4 | Tetraksidi | Fosforioksidi (III, V) | --- |
Arseenioksidit
Kaava | IUPAC -systemaattinen nimi | Nimikkeistö | Perinteinen nimi |
AS2O3 | Diaseenitrioksidi | Arseenioksidi (III) | Arsenioso -anhydridi |
AS2O5 | Diaseeni pentaoksidi | Arseenioksidi (V) | Arseenihydridi |
Antimonioksidit
Kaava | IUPAC -systemaattinen nimi | Nimikkeistö | Perinteinen nimi |
SB2O3 | Trioksidi | Antimonioksidi (III) | Antimoninen anhydridi |
SB2O5 | Pentaoksidi | Antimonioksidi (V) | Antimoninen anhydridi |
Rikkioksidit
Kaava | IUPAC -systemaattinen nimi | Nimikkeistö | Perinteinen nimi |
Sw | Rikin monoksidi | Rikkioksidi (II) | Hypesulfuroiva anhydridi |
SO2 | Rikkidioksidi | Rikkioksidi (IV) | Rikihydridi |
SO3 | Rikkitrioksidi | Rikkioksidi (VI) | Rikkihappoanhydridi |
Seleenioksidit
Kaava | IUPAC -systemaattinen nimi | Nimikkeistö | Perinteinen nimi |
SEO | Seleenimonoksidi | Seleenioksidi (II) | Hypiploleeninen anhydridi |
SEO2 | Seleenidioksidi | Seleenioksidi (IV) | Haaleaihydridi |
SEO3 | Seleenitrioksidi | Seleenioksidi (VI) | Selénic anhydride |
Teluriooksidit
Kaava | IUPAC -systemaattinen nimi | Nimikkeistö | Perinteinen nimi |
Teo | Telurio -monoksidi | Telurio -oksidi (II) | Hyppydridi |
TEO2 | Teluriodioksidi | Telurio -oksidi (IV) | Telydridi |
TEO3 | Teluriotrioksidi | Telurio -oksidi (VI) | Telluurinen anhydridi |
Kloorioksidit
Kaava | IUPAC -systemaattinen nimi | Nimikkeistö | Perinteinen nimi |
Cl2o | Kloorimonoksidi | Kloorioksidi (I) | Hypoklojahydridi |
CL2O3 | Klooritrioksidi | Kloorioksidi (III) | Klorihydridi |
CL2O5 | Kloripentaoksidi | Kloorioksidi (V) | Kloorihydridi |
CL2O7 | Kloorin heptoksidi | Kloorioksidi (VII) | Perkloorihydridi |
Bromioksidit
Kaava | IUPAC -systemaattinen nimi | Nimikkeistö | Perinteinen nimi |
Br2o | Bromimonoksidi | Bromioksidi (i) | Hipobrominen anhydridi |
BR2O3 | Bromitrioksidi | Bromioksidi (III) | Bromihydridi |
BR2O5 | Bromi -pentaoksidi | Bromioksidi (V) | Bromihydridi |
BR2O7 | Bromi -heptaoksidi | Bromioksidi (VII) | Perbromi -anhydridi |
Jodioksidit
Kaava | IUPAC -systemaattinen nimi | Nimikkeistö | Perinteinen nimi |
I2o | Jodi -monoksidi | Jodioksidi (i) | Hypoyodoso -anhydridi |
I2o3 | Joditrioksidi | Jodioksidi (III) | Yodoso -anhydridi |
I2o5 | Jodi pentaoksidi | Jodioksidi (v) | Yodiumihydridi |
I2o7 | Jodi heptoksidi | Jodioksidi (VII) | Periódicoic anhydridi |

