Kalium Yodato (KIO3)
- 1357
- 359
- Arthur Terry II
Mikä on kaliumjodaaatti?
Kalium- tai kalium Yodato Yodato on epäorgaaninen jodiyhdiste, erityisesti suola, jonka kemiallinen kaava on KIO3. Halogeeniryhmän (f, cl, br, i, as) jodi tai jodi, tässä suolassa hapettumismäärä +5; Siksi se on vahva hapettava aine. Kio3 Se dissosioituu vesipitoisessa väliaineessa K -ionien luomiseksi+ Ja io3-.
Se syntetisoidaan reagoimalla kaliumhydroksidi yodiumhapolla: HIO3(aq) + Koh (s) => Kio3(aq) + h2Tai (l). Sitä voidaan myös syntetisoida reagoimalla molekyylijodi kaliumhydroksidilla: 3i2(S)+6KOH (S) => KIO3(aq) + 5ki (aq) + 3h2Tai (l).
Kalium yodato -ominaisuudet
 Kalium yodato -ulkonäkö
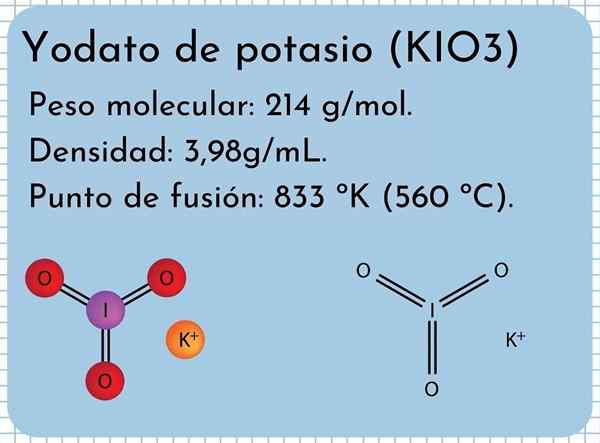
Kalium yodato -ulkonäkö Se on hajuton valkoinen kiinteä, hienot kiteet ja monokliininen kiteinen rakenne. Sen tiheys on 3,98 g/ml, molekyylipaino 214 g/mol ja esittelee absorptiokaistat infrapunaspektrissä (IR).
Sillä on sulamispiste: 833 ºK (560 ºC), joka koostuu voimakkaista ionisista vuorovaikutuksista K -ionien välillä+ Ja io3-. Korkeammissa lämpötiloissa lämpöhajoamisreaktio, vapauttaen molekyylin happea ja kaliumjodidia:
2KIO3(s) => 2Ki (s) + 3o2(g)
Vedessä siinä on liukoisuuksia, jotka vaihtelevat välillä 4,74 g/100 ml - 0 ºC, jopa 32,3 g/100 ml 100 ºC: lla, tuottaen värittömät vesiliuokset. Lisäksi se on liukenematon alkoholiin ja typpihapoihin, mutta se liukenee laimennettuun rikkihappeen.
Sen affiniteetti veteen ei ole huomattava, mikä selittää miksi se ei ole hygroskooppista eikä sitä ole hydratoitujen suolojen muodossa (KIO3· H2JOMPIKUMPI).
Hapettava aine
Kalium Yodato, kuten sen kemiallinen kaava osoittaa, on kolme happiatomia. Tämä on voimakkaasti elektronegatiivinen elementti, ja tämän ominaisuuden vuoksi se jättää ”löydetyn” jodia ympäröivän elektronisen pilvivajeen.
Voi palvella sinua: inertit kaasutTämä puute - tai panos, tapauksen mukaan - voidaan laskea jodin hapettumismääränä (± 1, +2, +3, +5, +7), joka on +5 tämän suolan tapauksessa.
Mitä tämä tarkoittaa? Että ennen elektroneja pystyvän lajien jodi hyväksyy ne ionisessa muodossaan (IO3-) tulla molekyylijodiksi ja hapetusluku on yhtä suuri kuin 0.
Tämän selityksen jälkeen voidaan määrittää, että kaliumjodaaatti on hapettava yhdiste, joka reagoi voimakkaasti pelkistävien aineiden kanssa monissa redox -reaktioissa; Kaikista näistä tunnetaan jodikellona.
Jodikello koostuu redox -prosessista, joka on hitaita ja nopeita vaiheita, joissa nopeat vaiheet on merkitty KIO -liuoksella3 Rikkihapossa, johon tärkkelys lisätään. Sitten tärkkelys -aika tuotti ja ankkuroitu sen rakenteen kanssa laji i3-- Se tekee värikkäästä sinisestä ratkaisusta tummansiniseksi.
Io3- + 3 HSO3- → I- + 3 HSO4-
Io3- + 5 i- + 6 h+ → 3 I2 + 3 h2JOMPIKUMPI
Yllyttää2 + HSO3- + H2O → 2 i- + HSO4- + 2 h+ (Tärkkelyksen takia tummansininen)
Kemiallinen rakenne
 Kalium yodato -rakenne
Kalium yodato -rakenne Ylemmässä kuvassa havainnollistetaan kaliumjodaaatin kemiallinen rakenne. IO -anionin3- Sitä edustaa punaisen ja violetti pallo "jalusta", kun taas K -ionit+ Niitä edustavat violetti pallot.
Mutta mitä nämä jalustat tarkoittavat? Näiden anionien oikeat geometriset muodot ovat tosiasiallisesti trigonaalisia pyramideja, joissa happi muodostavat kolmionmuotoisen pohjan, ja jodipisteiden jakamattoman vääntömomentin yläkerrassa, miehittämällä tilaa ja pakottaa taittamaan I-O-linkin ja kaksi linkkiä I = O.
Voi palvella sinua: viinihappoTämä molekyyligeometria vastaa SP -hybridisaatiota3 jodin keskusatomista; Toinen näkökulma viittaa kuitenkin siihen, että yksi happeatomista muodostaa yhteyksiä jodin "D" -tapahtumiin, tosiasiallisesti SP -tyypin hybridisaatio3d -d2 (Jodi voi olla "D" -orbitaalit laajentamalla sen Valencia -kerrosta).
Tämän suolan kiteet voivat kärsiä rakenteellisista faasimuutoksista (muut järjestelyt kuin monokliiniset) seurauksena niistä erilaisista fyysisistä olosuhteista.
Kaliumjodaaatin käyttö ja sovellukset
Terapeuttinen käyttö
Kalium -yodatoa käytetään yleensä välttääkseen kilpirauhasen radioaktiivisuuden kertymisen 131I, kun tätä isotooppia käytetään määrittämään jodi kilpirauhanen komponentiksi kilpirauhanen toiminnasta.
Samoin kalium -yodatoa käytetään ajankohtaisena antiseptisena (0,5 %) limakalvoissa.
Käyttö teollisuudessa
Se lisätään jalostuseläinten ruokaan jodilisäaineena. Siksi teollisuudessa käytetään kalium -yodatoa jauhojen laadun parantamiseksi.
Analyyttinen käyttö
Analyyttisessä kemiassa stabiilisuutensa ansiosta sitä käytetään ensisijaisena kuviona natriumtiosulfaattikuvioiden standardisoinnissa (NA2S2JOMPIKUMPI3), tarkoituksena määrittää jodipitoisuudet ongelmien ongelmiin.
Tämä tarkoittaa, että jodimäärät voidaan tietää tilavuustekniikoilla (aste). Tässä reaktiossa kaliumjodati hapettuu nopeasti jodidi -ioneihin I-, Seuraavan kemiallisen yhtälön kautta:
Voi palvella sinua: lyijyasetaatti: rakenne, ominaisuudet, hankkiminen, käyttöIo3- + 5i- + 6H+ => 3i2 + 3H2JOMPIKUMPI
Jodi, minä2, on nimeltään NA -liuoksen kanssa2S2JOMPIKUMPI3 sen standardointia.
Käyttö lasertekniikassa
Tutkimukset ovat osoittaneet ja vahvistaneet mielenkiintoisen pietsosähköisen, pyroelektrisen, sähköoptisen, ferroelektrisen ja ei -lineaarisen optiikan ominaisuudet KIO -kiteiden ominaisuudet3. Tämä johtaa suuriin potentiaaleihin elektronisella kentällä ja laserien tekniikassa tällä yhdisteellä valmistetut materiaalit.
Kaliumjuoteisen terveysriskit
Suurina annoksina se voi aiheuttaa ärsytyksiä suun limakalvossa, ihossa, silmissä ja hengitysteissä.
Kaliumjodaaatin toksisuuden kokeet eläimissä ovat antaneet meille mahdollisuuden havaita, että koirilla nopeasti, annoksilla 0,2-0,25 g/kg ruumiinpainoa, suun kautta toimitetaan, yhdiste aiheuttaa oksentelun.
Jos näitä oksentelua vältetään, se tuottaa eläimissä heidän tilanteensa pahenemista, koska anoreksia ja aikaisempi ennen kuolemaa indusoidaan. Hänen ruumiinavauksensa antoivat tarkkailla nekroottisia maksavaurioita, munuaisia ja suoliston limakalvoja.
Hapettavan voimansa vuoksi se edustaa tulen riskiä, kun se joutuu kosketuksiin syttyvien materiaalien kanssa.
Viitteet
- Päivä, r., & Underwood, a. Kvantitatiivinen analyyttinen kemia (Viides ed.-A. Pearson Prentice Hall, P-364.
- Kemikaalikirja. (2017). Kaliumjoda. Haettu 25. maaliskuuta 2018, Chemicalbook: Chemicalbook.com
- Pubchem. (2018). Kaliumjoda. Haettu 25. maaliskuuta 2018, PubChem: Pubchem.NCBI.Nlm.NIH.Hallitus
- Merkki. (2018). Kalium yodato. Haettu 25. maaliskuuta 2018 Merckistä:
- Merckmillipore.com
- M m Abdel Kader et ai. (2013). Varauskuljetusmekanismi ja matala lämpötilan vaihesiirtymät Kiossa3. J -. Fyysinen.: Conf. Olla. 423 012036

