Kaliumasetaatirakenne, ominaisuudet, käytöt, hankkiminen
- 1193
- 247
- Shawn Stanton II
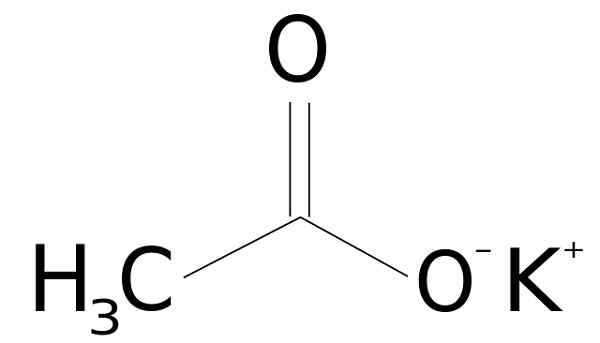
Hän kaliumasetaatti Se on orgaaninen yhdiste, jonka muodostaa ionikalium k+ ja ioniasetaatti Cho3Kujertaa-. Sen kemiallinen kaava on CHO3Kokki tai kch3COO tai myös C2H3Koolainen2. Se on väritön tai valkoinen kiteinen kiinteä, erittäin liukoinen veteen.
Sitä käytetään tiettyjen teollisesti jalostettujen elintarvikkeiden happamuuden säätelemiseen. Koska se on suuri affiniteetti veteen, sitä käytetään laboratorioissa tai tietyissä prosesseissa veden absorboimiseksi muista yhdisteistä, esimerkiksi kuivumaan alkoholia.
 KCH -kaliumasetaatti3CO palvelee joidenkin jalostettujen elintarvikkeiden happamuutta. Kirjoittaja: Ritae. Lähde: Pixabay.
KCH -kaliumasetaatti3CO palvelee joidenkin jalostettujen elintarvikkeiden happamuutta. Kirjoittaja: Ritae. Lähde: Pixabay. Kaliumasetaatti osallistuu joihinkin kemiallisiin reaktioihin, kuten niiden kiihdyttimeen ja orgaanisten yhdisteiden synteesiin. Se mahdollistaa myös vasta -aineiden muodostumisen (luonnolliset aineet, jotka taistelevat infektioita) teollisuusmenetelmissä niiden tuottamiseksi.
Sen ominaisuudet erittäin alhaisissa lämpötiloissa tekevät siitä hyvän ehdokkaan, jota käytetään seoksissa jäätelin sulamiseen betoniteillä erittäin kylmässä ilmastossa. Kuultujen lähteiden mukaan sitä käytetään myös laitteissa tulipalojen ja kokoonpanojen torjumiseksi solujen tarkkailemiseksi mikroskoopissa.
[TOC]
Rakenne
Kaliumasetaatti muodostuu kaliumkationista k+ ja anioniasetaatti Cho3Kujertaa-. Jälkimmäinen on etikkahappo CH: n konjugoitu emäs3Haittaa. Asetaatti Cho3Kujertaa- koostuu metyyli -CH: sta3 yhdessä karboksylaatin kanssa -COO-.
Molempien ionien välinen liitto on sähköstaattinen tai ioninen, ts. Positiivisen ja negatiivisen ionin välinen liitto.
 Kaliumasetaatirakenne ch3kokki. SSSILVER [julkinen alue]. Lähde: Wikimedia Commons.
Kaliumasetaatirakenne ch3kokki. SSSILVER [julkinen alue]. Lähde: Wikimedia Commons. Nimikkeistö
- Kaliumasetaatti
- Kalium -etanoaatti
- Etikkahappo kaliumsuola
- Aukko
- Koac
Ominaisuudet
Fyysinen tila
Väritön kiinteä tai kiteinen valkoinen.
Molekyylipaino
98,14 g/mol
Sulamispiste
292 ºC
Tiheys
1,6 g/cm3
Liukoisuus
Hyvin liukoinen veteen: 256 g/100 ml 20 ° C: ssa.
PHE
5-prosenttisen kaliumasetaatin vesiliuoksen pH on 7,5-9,0.
Muut ominaisuudet
Joskus sillä on heikko etikan tuoksu. 10-prosenttisessa liuoksessa ei hyökkää alumiinia huoneenlämpötilassa, mutta 60-70 ° C: ssa metalli tummenee ja kärsii puremista.
Yli 20%: n pitoisuuksissa pintahyökkäys alumiiniin tapahtuu missä tahansa lämpötilassa.
Voi palvella sinua: HydrceKaliumasetaatti (ACOK) on erittäin liukoinen veteen. Siinä on hydraatti: kch3Kujertaa.1,5h2Tai, joka on kiinteä kiinteä, joka saadaan kiteyttämällä se vesipitoisista ACOK -liuoksista.
Käyttäytyminen lämmittäessä
Jos kaliumasetaatti (ACOK) (KCH (KCH) toimitetaan lämmitykseen (KCH3Kujertaa.1,5h2O) Saavuttuaan 40 ° C: n nestevesi alkaa menettää.
Kch3Kujertaa.1,5h2O → kch3COO + 1,5H2Tai ↑
Jos vedetön kaliumasetaatti lämmitetään (ilman vettä: kch3COO), kun saavutetaan 340 ° C, se alkaa hajottaa kaliumkarbonaatin muodostamisen k2Yhteistyö3 Seuraavan reaktion mukaan:
2 kch3COO + 4 o2 → K2Yhteistyö3 + 3 h2O + 3 Co2↑
Saada
Se voidaan valmistaa KOH -kaliumhydroksidin vaikutuksella useisiin yhdisteisiin, kuten Cho Acid3COOH, etikkahydridi (CH3Co)2O ja ammoniumasetaatti Cho3Poonh4.
Koh +ch3Cooh → ch3Kokki + h2JOMPIKUMPI
Se voidaan saada myös reagoimalla kaliumkarbonaatti k2Yhteistyö3 o khco kaliumbikarbonaatti3 Etikkahappo CH: n kanssa3Haittaa.
Khco3 + CH3Cooh → ch3Kokki +h2Tai + Co2↑
Kaliumasetaatti voidaan kiteyttää vesiliuoksesta sen saamiseksi, jolla on suuri puhtaus.
Sovellukset
Useissa sovelluksissa
Kaliumasetaattia käytetään jalostetussa elintarviketeollisuudessa happamuussäätimenä. Sitä käytetään kuivausaineena kemiallisissa menetelmissä joidenkin kankaiden vesihöyryn läpäisevyyden mittaamiseksi.
Se toimii etanolin kuivausaineena tämän alkoholin tuotannossa, joka perustuu lignoselluloosaan, puusta johdettuun materiaaliin.
Sitä käytetään antibioottien tuottamiseen ja sitä käytetään laajasti palotaistelulaitteissa.
Polymeeriteollisuudessa
Sitä käytetään polyuretaanien kierrättämiseen, koska sillä on tällaisten polymeerien hydrolyysi- ja glykolyysireaktioiden katalysointi tai kiihdyttäminen alkoholiksi ja amiiniksi.
Sitä käytetään myös orgaanisten silikonihartsien tuotannossa.
Tieteellisissä ja lääketieteellisissä tutkimuslaboratorioissa
Korkeasti puhtaita kaliumasetaattia käytetään laboratorioissa analyyttisenä kemian reagenssina. Myös lääketieteellisen tutkimuksen suorittamiseksi.
Voi palvella sinua: Neon: Historia, ominaisuudet, rakenne, riskit, käyttötarkoituksetHistopatologialaboratorioissa se varmistaa neutraalin pH -väliaineen mikroskooppikokoonpanoissa.
 Kaliumasetaatilla on erilaisia käyttötarkoituksia kemiallisissa ja lääketieteellisissä tutkimuslaboratorioissa. Kirjoittaja: Michal Jarmoluk. Lähde: Pixabay.
Kaliumasetaatilla on erilaisia käyttötarkoituksia kemiallisissa ja lääketieteellisissä tutkimuslaboratorioissa. Kirjoittaja: Michal Jarmoluk. Lähde: Pixabay. Sitä käytetään heterosyklisten orgaanisten yhdisteiden synteesiin, jotka ovat yhdisteitä, joiden syklit ovat erikokoisia.
Tietyt mikroelektrodit, jotka palvelevat solujen sähköisiä ominaisuuksia, täytetään konsentroituneella kaliumasetaattiliuoksella.
Vasta -aineiden teollisessa tuotannossa
Kaliumasetaatti palvelee monoklonaalisten vasta -aineiden (jotka ovat samasta kantasolusta) suurta tuotantoa soluviljelmissä. Se mahdollistaa synteesin tai vasta -aineiden muodostumisen stimuloinnin.
Vasta -aineet ovat aineita, joita jotkut verisolut tuottavat viruksen tai bakteeri -infektioiden torjumiseksi.
 Taiteellinen vasta -ainekuva. KCH -natriumasetaatti3CO palvelee vasta -aineiden tuotannossa suurina määrinä. Blitzkrieg1982 [CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons.Vaikka kaliumasetaatti (ACOK) estää tai hidastaa solujen kasvua ja vähentää solutiheyttä, vasta -aineiden tuottavuus jokaiselle solulle kasvaa.
Taiteellinen vasta -ainekuva. KCH -natriumasetaatti3CO palvelee vasta -aineiden tuotannossa suurina määrinä. Blitzkrieg1982 [CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons.Vaikka kaliumasetaatti (ACOK) estää tai hidastaa solujen kasvua ja vähentää solutiheyttä, vasta -aineiden tuottavuus jokaiselle solulle kasvaa.
 Vasta -ainehyökkäys piirtämällä joillekin bakteereille. SA1590 [CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons.
Vasta -ainehyökkäys piirtämällä joillekin bakteereille. SA1590 [CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons. Antihielo -seoksissa
Kaliumasetaattia on käytetty antihielo -seoksissa (englanninkielinen käännös Jään vastainen;.
 Talviaseman aikana tiet ovat täynnä lunta ja jäätä. Kaliumasetaatti voi olla hyödyllinen tällaisissa tapauksissa. Kirjoittaja: S. Hermann & F. Rikkaus. Lähde: Pixabay.
Talviaseman aikana tiet ovat täynnä lunta ja jäätä. Kaliumasetaatti voi olla hyödyllinen tällaisissa tapauksissa. Kirjoittaja: S. Hermann & F. Rikkaus. Lähde: Pixabay. Kaliumasetaattivalinta (ACOK) tälle sovellukselle johtuu 50%: n vesiliuoksesta ACOK -painolla on eutttinen ja sen fuusiopiste on -62 ° C. Tämä tarkoittaa, että jopa lämpötiloissa niin alhaiset kuin -62 ° C liuos pysyy sulana.
Euttinen on homogeeninen komponenttien seos, jolla on pienin sulamispiste kaikista mahdollisista seoksista, mukaan lukien puhtaat komponentit.
Kuinka se toimii antihielona
Kaliumasetaatilla (ACOK) on erittäin hyvä kyky sulattaa jää.
-5 ° C pystyy sulamaan 11,5 kg jäätä jokaiselle kg ACOK: ta kohtaan. Tämä ominaisuus vähenee laskemalla lämpötilaa, mutta jopa -50 ° C: seen on kyky sulattaa 1,3 kg jäätä jokaiselle kg ACOH: ta kohtaan.
Voi palvella sinua: kiteiset kiinteät aineet: rakenne, ominaisuudet, tyypit, esimerkitA -5 ° C Tämä kapasiteetti on verrattavissa natriumkloridin tai pöytäsuolan (NaCl) kapasiteettiin, kun taas -30 ° C FAR.
 Kaliumasetaatti antaa sinun sulattaa jäätä jäädytetyillä teillä. Kirjoittaja: Markus Sch. Lähde: Pixabay.
Kaliumasetaatti antaa sinun sulattaa jäätä jäädytetyillä teillä. Kirjoittaja: Markus Sch. Lähde: Pixabay. ACOK: n kanssa suoritetuissa testeissä havaittiin kuitenkin yhdessä muiden yhdisteiden kanssa tietty sementtipintojen korroosioaste, joten ehdotettiin lisäämään antikroosivia antihielo -seoksiin.
Toisaalta kaliumasetaattiseos (CH3Kokki) kaliummuodostuksella (HCOOK) on erinomainen antihielo, eikä se vaadi antikorroosia.
Viitteet
- Leipuri, f.J -. et al. (1976). Värjäysmenettelyt. Vesipitoiset vuoret. Johdanto lääketieteelliseen laboratoriotekniikkaan (viides painos). ScienEdirect.com.
- Hassan, a.-Lla. et al. (2018). Inzolit: synteesi ja sidoksen muodostava heterosyklisointi. Heterosyklisen kemian edistyksessä. ScienEdirect.com.
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Kaliumasetaatti. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Das, a. ja Alagirusamy, R. (2010). Kosteuden siirto. Kuivausaineen käänteinen kuppimenetelmä. Tieteessä vaatteiden mukavuudessa. ScienEdirect.com.
- Vargel, c. (2004). Karboksilapot ja niiden johdannaiset. Asetaatit. Alumiinin korroosiossa. ScienEdirect.com.
- Cuevas, j. (2014). Elektrofysiologiset tallennustekniikat. Solunsisäiset tallennustekniikat. Biolääketieteen viitemodulaatiossa. ScienEdirect.com.
- Fink, j.K -k -. (2018). Poly (uretaani) s. Kierrätys. Solvolyysi. Reaktiivisissa polymeereissä: perusta ja sovellukset (kolmas painos). ScienEdirect.com.
- Fong, w. et al. (1997). Monoklonaalisen vasta -ainetuotannon optimointi: kaliumasetaatin ja perfuusion yhdistetyt vaikutukset sekoitettuun säiliöbioreaktoriin. Cytotechnology 24: 47-54. Linkki palautettu.Jousto.com.
- Danilov, V.P. et al. (2012). Matalan lämpötilan jääntöreagenssit vesipitoisissa suolajärjestelmissä, jotka sisältävät asetaatteja ja muodollisia. Teoreettiset perusteet Chemical Engineering, 2012, osa 46, ei. 5, pp. 528-535. Linkki palautettu.Jousto.com.
- Fakev, a.-Lla.et al. (2012). TUTKIMUS JA TUTKIMUS Kaliumasetaatin, jolla on korkea puhtaus. Journal of Applied Chemistry, 2012, osa. 85, ei.12, pp. 1807-1813. Linkki palautettu.Jousto.com.
- « Magneettiset sokkiyksiköt, kaavat, laskelmat, esimerkit
- Ominaisuuksien syöttölaitteet, mitkä ovat käyttö, tyypit, esimerkit »

