Lämpöalkoholirakenne, ominaisuudet, riskit ja käyttötarkoitukset
- 4269
- 650
- Shawn Stanton II
Hän Lämmön alkoholi Se on orgaaninen yhdiste, jonka kaava on (ch3-A3Coh tai t-buoh. Tämä on kaikkien yksinkertaisin korkea -asteen alkoholi. Ympäristön lämpötilasta riippuen se esitetään kiinteänä tai nestemäisenä värittömänä. Alemmassa kuvassa he osoittavat esimerkiksi värittömät kiteet.
Tämä alkoholi ei ole substraatti entsyymi -alkoholidehydrogenaasille tai katalaasin peroksidaasiselle aktiivisuudelle, joten se luokitellaan ei -metaboloimattomaksi alkoholiksi. Biokemiallisten ominaisuuksiensa vuoksi ajatellaan, että se voisi olla hyödyllinen hydroksiilien havaitsemisessa in vivo ehjissä soluissa.

Se on yksi isobutiilisen alkoholin neljästä isomeeristä, mikä on vähemmän herkkä isomeeri hapettumiselle ja vähiten reaktiivinen. Luonnossa sitä löytyy piikkikerrasta ja kassavasta tai kassavasta, juurista, joka on käynyt alkoholijuomien tuottamiseksi.
Lämpöalkoholi on hyvin liukoinen veteen ja orgaanisiin liuottimiin. Sen pääkäyttö on liuotin, joka täyttää tämän roolin muovien, hajuvesien, maalausmuutosten jne. Kehittämisessä jne.
Kuten monet orgaaniset yhdisteet, se on vähän myrkyllinen, mutta suurina annoksina sillä on huumausaine, jolle on ominaista päänsärky, vahidos, huimaus, huimaus ja rappeutuminen.
[TOC]
Lämpöalkoholirakenne
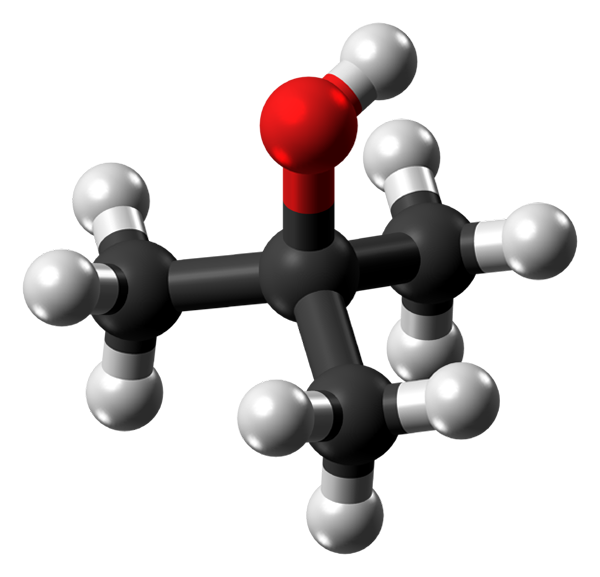
 Lämmön alkoholimolekyyli. Lähde: Jynto Wikipedian kautta.
Lämmön alkoholimolekyyli. Lähde: Jynto Wikipedian kautta. Yläkuvassa sinulla on lämpöalkoholin molekyylirakenne pallo- ja tankojen malli. Koko molekyylissä on globaali tetraedrinen geometria, kolmas hiili sijaitsee sen keskellä ja ryhmät3 ja oi sen kärjessä.
Tätä rakennetta tarkkailemalla ymmärretään, miksi tämä alkoholi on tertiäärinen: keskuksen hiili on kytketty kolmeen muuhun hiilihiileen. Jatkamalla tetraedron kanssa, sen alaosaa voidaan pitää apolaarina, kun taas sen ylempi kärki, polaari.
Se voi palvella sinua: Fehling -reaktio: valmistelut, aktiiviset edustajat, esimerkit, käyttöTässä kärkipisteessä on OH-ryhmä, joka luo pysyvän dipolin ja antaa myös T-buoh-molekyylien vuorovaikutuksen vety silloilla; Samalla tavalla kuin vesimolekyyleillä ja muilla napa -aineilla.
T-buah-kiteissä nämä vety sillat ovat avaintekijä molekyyleille pysyä yhdessä; Vaikka tämän alkoholin kiteinen rakenne ei ole liikaa tietoa.
Kun OH -ryhmä on niin lähellä ja ympäröimä apolariryhmiä3, Vesimolekyylit onnistuvat hydratoimaan melkein kaikki alkoholit vuorovaikutuksessa OH: n kanssa. Tämä selittäisi sen suuren liukoisuuden veteen.
Ominaisuudet
Kemialliset nimet
-Lämmön alkoholi
-Ter-butanoli
-2- metyyli-2-propanoli
-2-metyylipropan-2-OL.
Molekyylikaava
C4H10O o (Cho3-A3Koho.
Molekyylipaino
74 123 g/mol.
Fyysinen kuvaus
Väritön kiinteä tai väritön neste ympäristön lämpötilasta riippuen, koska sulamispiste on 77,9 ºF (25,4 ºC). Yli 77,9 ºF on neste.
Haju
Samanlainen kuin kamferi.
Kiehumispiste
82,4 ºC.
Sulamispiste
77,9 ºF (25,4 ºC).
sytytyspiste
52 ºF (11 ºC). Suljettu kuppi.
Vesiliukoisuus
Erittäin liukoinen. Itse asiassa riippumatta mittasuhteista, tämä alkoholi on aina sekoittumassa veden kanssa.
Liukoisuus orgaanisiin liuottimiin
Sekoittuu etanolin, etyylieetterin kanssa ja liukoinen kloroformiin.
Tiheys
0,78 g/cm3.
Höyrytiheys
2,55 (ilmasuhteella = 1).
Höyrynpaine
4,1 kPa 20 ° C: ssa.
Oktanoli/vesijakokerroin
Log p = 0,35.
Lämmönlämpötila
Epävakaa kuumassa
Itsenistuneen lämpötila
896 ºF (470 ºC).
Voi palvella sinua: Alikvotti (kemia)Hajoaminen
Lämmitettäessä voi vapauttaa hiili- ja isobutileenimonoksidihöyryt.
Höyrystyslämpö
39,07 kJ/mol.
Kalorikapasiteetti
215 37 JK-1molo-1.
Koulutus-
-360.04 --358,36 KJmol-1.
Säilytyslämpötila
2-8 ºC.
Vakaus
Se on vakaa.
Ionisaatiopotentiaali
9,70 eV.
Hajukynnys
219 mg/m3 (matala haju).
Taitekerroin
1 382 - 25 ° C.
Dissosiaatiovakio
PKA = 19,20.
Suurin höyrypitoisuus
5,53 % 25 ° C: ssa.
Reaktiot
-Vahva pohja on epämiellyttävä alkoholianionin aiheuttamiseksi; Erityisesti terbutoksidi (ch3-A3Yhteistyö-.
-Lämpöalkoholi reagoi vetykloridin kanssa terbutyylikloridin muodostamiseksi.
(CH3-A3Coh +hcl => (ch3-A3CCL +H2JOMPIKUMPI
Tertiääriset alkoholit ovat suurempi reaktiivisuus vetyhalogeenien kanssa kuin sekundaarisilla ja primaarisilla alkoholilla.
Riskejä
Lämpöalkoholi kosketuksella ihon kanssa tuottaa lievää vaurioita, kuten punoitus- ja ei -surkeaa hyperemiaa. Lisäksi se ei ylitä ihoa. Päinvastoin, silmissä se aiheuttaa vakavaa ärsytystä.
Kun se hengitetään, se aiheuttaa ärsytystä nenässä, kurkussa ja keuhkoputkissa. Suuren altistumisen tapauksessa voi tapahtua huumausainevaikutuksia, uneliaisuuden tilaa sekä haalistumista, vahidoja ja päänsärkyä.
Tämä alkoholi on kokeellinen teratogeeninen aine, joten eläimissä on havaittu, että se voi vaikuttaa synnynnäisten häiriöiden esiintymiseen.
Sen varastoinnin suhteen sen neste ja höyryt ovat syttyviä, ja siksi tietyissä olosuhteissa se voi tuottaa tulipaloja ja räjähdyksiä.
OSHA asetti 100 ppm -pitoisuusrajan (300 mg/m3) 8 tunnin päivälle.
Voi palvella sinua: ProsenttiosuusratkaisutSovellukset
-Lämpöalkoholia käytetään lämpöryhmän sisällyttämiseen orgaanisiin yhdisteisiin öljyjen liukoisten öljyjen ja trinitro-tter-butletolueenin, keinotekoisen myskin, valmistamiseksi, keinotekoinen myski. Lisäksi se muodostaa alkuperäisen materiaalin peroksidien valmistukseen.
-FDA on hyväksynyt sen loistavan aineena käytettäväksi komponenteissa ja muovimateriaaleissa, jotka ovat kosketuksissa ruoan kanssa. Sitä on käytetty hedelmien, muovien ja lacas essencien kehittämisessä.
-Se on välittäjä terbutyyli- ja tributilfenolikloridin tuotannossa. Se toimii etanolin denaturoivana aineena.
-Tarjoile vaahdotusaineiden valmistukseen orgaanisena liuottimena maalausten poistamiseksi ja hajuvesien käytettyjen olemusten liuottamiseksi.
-Sitä käytetään bensiinin oktaaniarvoa; polttoaine- ja polttoaineen lisäaine; Liuotin, jota voidaan käyttää puhdistuksessa ja kurjaksi.
-Lämpöalkoholi on välittäjä terbutyylimetyylieetterin (MTBE) ja tributiletyylieetterin (ETBE) tuotannossa, mikä reagoi vastaavasti metanolin ja etanolin kanssa.
-Se toimii myös samalla tavalla tributyylihydroperoksidin (TBHP) tuotannossa reaktiolla vetyperoksidin kanssa.
-Sitä käytetään reagenssina prosessissa, joka tunnetaan nimellä Curtius backreglo.
Viitteet
- Graham Solomons t.W -., Craig B. Freedle. (2011). Orgaaninen kemia. Amiini. (10th Painos.-A. Wiley Plus.
- Wikipedia. (2019). Tert-butyylialkoholi. Haettu: vuonna.Wikipedia.org
- Kohteinen. (S.F.-A. T-butanoli. Toipunut.com
- Kansallinen bioteknologiatietojen keskus. (2019). Tert butanoli. Pubchem -tietokanta. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Carey f. -Lla. (2008). Orgaaninen kemia. (Kuudes painos). MC Graw Hill.
- « Asenteelliset sisällön ominaisuudet ja esimerkit
- Mitä 2000 -luvun lasten ja nuorten pitäisi oppia toimimaan nykymaailmassa? »

