Alkynit
- 900
- 82
- Eddie Hackett
 Alvento -rakenne, kolminkertaisella linkillä
Alvento -rakenne, kolminkertaisella linkillä Mitä ovat alkines?
Se Alkynit Ne ovat hiilivetyjä tai orgaanisia yhdisteitä, jotka esiintyvät rakenteissaan kolminkertainen linkki kahden hiilen välillä. Tätä kolminkertaista linkkiä (≡) pidetään funktionaalisena ryhmänä edustaessasi molekyylin aktiivista paikkaa, ja siksi se on vastuussa niiden reaktiivisuudesta.
Vaikka alkynit eivät eroa paljon alkoista tai alkeenista, niillä on suurempi happamuus ja napaisuus niiden linkkien luonteen vuoksi. Tarkka termi tämän pienen eron kuvaamiseksi on niin tyydyttämättömyys.
Alkaanit ovat tyydyttyneitä hiilivetyjä, kun taas alkinit ovat tyydyttyvimpiä alkuperäisen rakenteen suhteen. Mitä tämä tarkoittaa? Että alkaani H3C-C-CH3 (etaani) voi olla dehydyä h: ksi2C = ch2 (Etene) ja myöhemmin Hc irti (etino, tai tunnetaan paremmin asetyleeni).
Huomaa, kuinka hiilihiilien keskuudessa muodostuessa lisälinkkejä vähentää niihin kytkettyjen vetyjen lukumäärää. Hiilellä elektronisten ominaisuuksiensa vuoksi pyrkii muodostamaan neljä yksinkertaista linkkiä, joten mitä suurempi on taipumus reagoida (paitsi aromaattiset yhdisteet).
Toisaalta kolminkertainen linkki on paljon vahvempi kuin kaksinkertainen (=) tai yksinkertainen (-) joukkovelkakirjalaina, mutta korkealla energiakustannuksella. Siksi suurin osa hiilivedyt (alkaanit ja alkeenit) voivat muodostaa kolminkertaisia sidoksia korkeissa lämpötiloissa.
Näiden korkeiden energioiden seurauksena ne vapautuvat erittäin kuumiksi. Käytetään esimerkki tästä ilmiöstä, kun asetyleeni palaa happea ja käytetään liekin voimakasta lämpöä hitsaamiseen tai sula metalleihin.
Asetyleeni on yksinkertaisin ja pienin alkykyni. Muut hiilivedyt voidaan ilmaista niiden kemiallisesta kaavasta korvaamalla h alquilical -ryhmillä (RC≡CR '). Sama tapahtuu orgaanisen synteesin maailmassa suuren määrän reaktioiden kautta.
Tämä alkyyni tapahtuu kalkkikiven ja kokin kalsiumoksidin reaktiosta, raaka -aineesta, joka tarjoaa tarvittavat hiilit sähköuunin sisällä:
Cao + 3c => cac2 + Yhteistyö
CAC2 Se on kalsiumkarbidi, epäorgaaninen yhdiste, joka lopulta reagoi veden kanssa asetyleenin muodostamiseksi:
Cac2 + 2H2O => ca (OH)2 + Hc irti
Alkinien fysikaaliset ja kemialliset ominaisuudet
Vastakkaisuus
Kolminkertainen linkki erottaa alkinit alkaanista ja alkeenista. Kolme hiilivetytyyppiä ovat apolaarisia, liukenemattomia veteen ja erittäin heikkoihin happoihin. Kaksois- ja kolminkertaisten sidosten hiilihiilien elektronegatiivisuus on kuitenkin suurempi kuin yksinkertaisten hiilihiilien.
Tämän mukaan hiilihiilit kolminkertaisen sidoksen saannon vieressä induktiiviseen vaikutukseen negatiiviseen kuormitustiheyteen. Tästä syystä, missä ovat C≡C tai C = C -linkit, siellä on suurempi elektroninen tiheys kuin muualla hiilihapollisessa luurankoissa. Seurauksena on pieni dipolimomentti, jossa molekyylit ovat vuorovaikutuksessa dipoli-dipolovoimien avulla.
Nämä vuorovaikutukset ovat erittäin heikkoja, jos niiden dipolimomentteja verrataan vesimolekyylin tai minkä tahansa alkoholin momenttiin. Tämä heijastuu niiden fysikaalisiin ominaisuuksiin: Alkineilla on yleensä korkeampi fuusio- ja kiehumispisteet verrattuna niiden vähemmän tyydyttymättömien hiilivetyjen ominaisuuksiin.
Voi palvella sinua: 7 tärkeintä biokemian sovellustaSamoin heidän alhaisen napaisuuden vuoksi ne ovat vähemmän liukenemattomia veteen, mutta liukoiset apolaarisiin orgaanisiin liuottimiin, kuten bentseeni.
Happamuus
Myös tämä elektronegatiivisuus aiheuttaa vetyä HC≡Cr on happamempi kuin kukaan muissa hiilivedyissä. Siksi alkinit ovat lajeja happamempia kuin alkeenit ja paljon enemmän kuin alkaanit. Sen happamuus on kuitenkin halveksittava verrattuna karboksyylihappoihin.
Koska alkinit ovat erittäin heikkoja hapoja, ne reagoivat vain erittäin vahvojen emäksien, kuten natriumin amiduro -ohjelmien kanssa:
HC≡CR + Nanh2 => Hc irti + nh3
Tästä reaktiosta saadaan natrium -asetylointiliuos, raaka -aine muiden alkynien synteesiä varten.
Alquinosin reaktiivisuus
Alkynien reaktiivisuus selitetään lisäämällä pienet molekyylit kolminkertaiseen linkkiin, vähentäen sen tyydyttymistä. Nämä voivat olla vetymolekyylejä, vetyhallogenidejä, vettä tai halogeenia.
Hydraus
Pikku H -molekyyli2 Se on erittäin vaikeaa ja nopeaa, joten lisätä mahdollisuuksia lisätä Alkines -linkkiin.
Nämä ovat yleensä metalleja (PD, PT, RH tai Ni) hienosti jaettuna pinta -alan lisäämiseksi; Ja tällä tavalla vedyn ja alquinon välinen kosketus:
Rc irticr ' + 2h2 => Rch2CH2R '
Tuloksena on, että vety on "ankkuri" hiilihiileille, jotka rikkovat sidoksen, ja niin edelleen, kunnes vastaava alkaani tuottaa, RCH2CH2R '. Tämä ei vain kyllästä alkuperäistä hiilivetyä, vaan myös modifioi sen molekyylirakennetta.
Vety halogeenien lisääminen
Täällä lisätään epäorgaaninen molekyyli HX, missä x voi olla mikä tahansa halogeeneistä (F, Cl, BR tai I):
Rc irticr ' + hx => rch = cxr'
Kosteus
Alkinien hydraatio on, kun ne lisäävät vesimolekyylin aldehydin tai ketonin muodostamiseksi:
Rc irticr ' + h2O => rch2Cor '
Jos r 'on H, se on aldehydi; Jos se on vuokra, se on Cetona. Reaktiossa enol -niminen yhdiste (rch = c (OH) r ') muodostuu välittäjäksi.
Tämä kärsii enolisen muodon (C-OH) muuntamisesta ketoniksi (C = O) tasapainossa, jota kutsutaan tautomerisaatioksi.
Halogeenien lisääminen
Ja lisäysten suhteen halogeenien diatomiset molekyylit voidaan myös ankkuroida hiiliin (x x2= F2, Cl2, Br2 kuulin2)
Rc irticr ' + 2x2 => Rcx2-Cx2R '
Asetyleenialkylointi
Natriumasetuksen liuoksesta muut alkinit voidaan valmistaa käyttämällä vuokra -halogenidia:
Hc irti
Esimerkiksi, jos se olisi metyylijodidi, tuloksena oleva alkyte olisi:
HcINCNA + ch3I => hc≡Cch3 + Nax
Hc irti3 on oikea, tunnetaan myös nimellä Metyyliasetyleeni.
Alkinien kemiallinen rakenne
 Alquinon kemiallinen rakenne
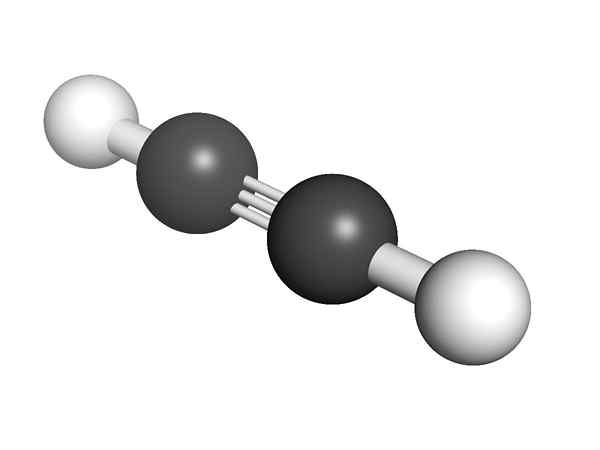
Alquinon kemiallinen rakenne Mikä on alkynien rakenne? Yläkuvassa esitetään asetyleenimolekyyli. C≡C -linkin lineaarinen geometria voi olla selvää siitä.
Siksi, missä on kolminkertainen sidos, molekyylin rakenteen on oltava lineaarinen. Tämä on toinen merkittävistä eroista niiden ja muun hiilivetyjen välillä.
Se voi palvella sinua: sykopropaani (C3H6)Alkaania esitetään yleensä siksakteinä, koska niillä on SP -hybridisaatio3 ja niiden linkit on erotettu 109º. He ovat oikeastaan kovalenttisesti yhtenäinen tetrahedraketju. SP -hybridisaation avulla alkeenit ovat tasaisia2 sen hiilistä, muodostaen tarkemmin trigonaalisen tason, jolla on erotetut linkit 120º: lla.
Alkyneissä kiertoradan hybridisaatio on SP, ts. Niillä on 50% S ja 50% P: stä. Asetyleeni- tai alkyyryhmissä H -atomeihin on kytketty kaksi SP -hybridi -kiertorataa,.
Etäisyys sekä H tai R on 180º, sen lisäksi, että vain tällä tavalla puhtaat hiilihiilit voivat muodostaa kolminkertaisen sidoksen. Tästä syystä linkki -c≡C- on lineaarinen. Minkä tahansa molekyylin rakenteen näkeminen -c≡C -korostukset alueilla, joilla luuranko on hyvin lineaarinen.
Etäisyys linkkien ja päätealmien perusteella
Kolminkertaisen sidoksen hiilit ovat pienemmällä etäisyydellä kuin kaksinkertaisesti tai yksinkertainen linkki. Toisin sanoen, C≡C on lyhyempi kuin c = c ja c-c. Seurauksena on, että linkki on vahvempi, koska kaksi π -linkkiä myötävaikuttavat yksinkertaisen linkin σ vakauttamiseen.
Jos kolminkertainen sidos on ketjun lopussa, se on terminaali alkyne. Siksi mainitun yhdisteen kaavan on oltava HC≡CR, jossa H huomauttaa ketjun päätä tai alkua.
Jos päinvastoin, se on kolminkertainen sisäinen linkki, kaava on RC≡CR ', missä R ja R' ovat ketjun oikea ja vasen puoli.
Alquinosin nimikkeistö
Kuinka alkines nimitetään IUPAC: n sanelemien sääntöjen mukaisesti? Samoin kuin alquenos ja alkeenit on nimitetty. Tätä varten jälkiliite -onin jälkiliite -Ano tai -Eo muuttuu.
Esimerkiksi: HC≡CCH3 Se on nimitetty vinkkejä, koska siinä on kolme hiilyä, kuten propaania (CHO3CH2CH3-A. HC≡CCH2CH3 Se on 1-butino, joka on terminaali alkyne. Mutta CHO: n tapauksessa3C katkes3 Tämä on 2-butino, ja tässä kolminkertainen linkki ei ole terminaali, vaan sisäinen.
CH3C katkes2CH2(CH3-A2 Se on 5-metyyli-2-heksine. Hiilit alkavat kolminkertaisen linkin lähinnä olevasta sivusta.
Toinen tyyppiset alkinit ovat sykloalquiinit. Heille riittää korvaamaan vastaavan sykloalcanin jälkiliite -Ano. Siten syklopropaani, jolla on kolminkertainen sidos, on nimetty syklopropiiniksi (jota ei ole).
Kun on kaksi kolminkertaista linkkiä, etuliite DI lisätään nimeen-. Sillä on esimerkkejä HC≡C-C Ei: lle, diasetyleenille tai propadiinille; Ja hc irti.
Alquinos käyttää
Asetyleeni tai etino
Pienin alkynit paksuuttaa näiden hiilivetyjen mahdollisen käyttömäärän. Siitä Alksin kautta muut orgaaniset yhdisteet voidaan syntetisoida. Se käy myös läpi hapettumireaktioita etanolin, etikkahapon, akryylihapon saamiseksi muun muassa.
Voi palvella sinua: litiumhydridi: rakenne, ominaisuudet, hankkiminen, käyttöMuut sen käyttötarkoitukset koostuvat lämmönlähteen tarjoamisesta atomien elektronien herättämiseksi; Tarkempi, metallikationien E-määrityksissä atomien absorptio-emissio, laajalti käytetty spektroskooppinen tekniikka.
Luonnonsuoja
Ainoat olemassa olevat menetelmät alkynien valmistamiseksi eivät ole vain synteettisiä tai lämmön levittämisessä hapen puuttuessa, vaan myös biologisia.
Näissä entsyymeissä kutsutaan asetyyli, joka voi kieltää kaksoissidoksen. Tämän ansiosta saavutetaan monia luonnollisia alkynien lähteitä.
Tämän jälkeen nämä lähteet voidaan erottaa myrkkyjä, vastalääkkeitä, lääkkeitä tai mikä tahansa muu yhdiste, joka tarjoaa minkä tahansa hyödyn; varsinkin kun se koskee terveyttä. Vaihtoehtoja on monia, kun muuttavat alkuperäisiä rakenteitaan ja saavat ne tukena uusille alkineille.
Esimerkkejä alkyneistä
Toistaiseksi on mainittu lukuisia esimerkkejä alkinista. Jotkut ovat kuitenkin peräisin hyvin erityisistä lähteistä tai niillä on erityisiä molekyylirakenteita: ne ovat polyasetyyliä.
Tämä tarkoittaa, että voi olla enemmän kuin kolminkertainen linkki, joka on osa erittäin suurta rakennetta, eikä vain yksinkertaisen hiilihapotettua ketjua.
Teriinihappo
 Säkkihapon rakenne
Säkkihapon rakenne Taririinihappo on peräisin Guatemalassa sijaitsevasta kasvista, nimeltään Picramnia Tariri. Se uutetaan erityisesti öljystä siemenistään.
Sen molekyylirakenteessa voidaan havaita yksi kolminkertainen linkki, joka erottaa apolaarisen hännän polaarisesta päästä; Siksi sitä voidaan pitää amfipaattisena molekyylinä.
Histrionikotoksiini
 Histrionikotoksiinirakenne
Histrionikotoksiinirakenne Histrionikotoksiini on myrkky, jonka on erotettu Kolumbian, Brasilian ja muiden Latinalaisen Amerikan maiden asukkaiden iho. Siinä on kaksi kolminkertaista konjugoitua linkkiä kaksoissidoksella. Molemmat ovat terminaaleja ja ne on erotettu kuuden hiilirenkaan ja syklisen amiinin avulla.
Sikutoksiini
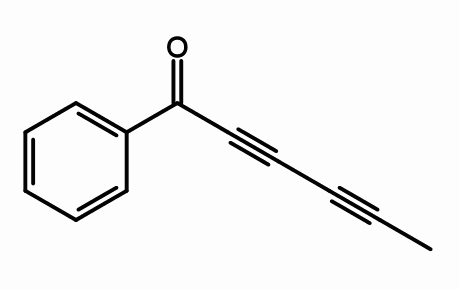 Sikutoksiinirakenne. Kirjoittanut giorgiogp2 [cc by-sa 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0) tai gfdl (http: // www.GNU.Org/copyleft/fdl.html)], Wikimedia Commons
Sikutoksiinirakenne. Kirjoittanut giorgiogp2 [cc by-sa 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0) tai gfdl (http: // www.GNU.Org/copyleft/fdl.html)], Wikimedia Commons Kikutoksiinin molekyylirakenteesta missä kolminkertaiset linkit ovat? Jos kaksoissidokset ovat tasaisia, kuten ne nähdään oikein, ja yksinkertaiset linkit ovat tetrahedraaleja, kuten päissä kolminkertaiset ovat lineaarisia ja ovat kaltevuudessa (\).
Tämä yhdiste koostuu neurotoksista, joka löytyy pääasiassa vesiparannuskasvista.
Kapillina
 Capillina -rakenne. Kirjoittanut Klever [CC0], Wikimedia Commons
Capillina -rakenne. Kirjoittanut Klever [CC0], Wikimedia Commons Se on artemiskasvien eteerisessä öljyssä läsnä oleva alkyni, jota käytetään sienilääkkeenä. Kaksi kolminkertaista peräkkäistä linkkiä voidaan havaita, konjugoitu oikein.
Mitä se tarkoittaa? Että kolminkertaiset sidokset resonoivat koko hiiliketjussa ja sisältää, että kaksoissidos C = O avataan C-O: lle-.
Pargiliini
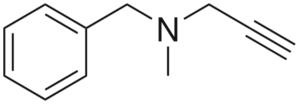 Pargiliinirakenne
Pargiliinirakenne Se on ylenmääräinen verenpainelääke. Sen rakenteen analysointi osittain on: Benchilo -ryhmä vasemmalle, keskellä oleva tertiäärinen amiini ja oikea -levy; eli terminaaliominaisuusryhmä.
Viitteet
- Francis a. Kilpikonnan. Orgaaninen kemia. Karboksyylihapot. (Kuudes painos., Sivu 368-397). MC Graw Hill.
- Brennan, John. (10. maaliskuuta 2018). Esimerkki alkyneistä. Tiede. Otettu: tiedekunta.com
- Byju. (2018). Kolminkertainen sidos alkyneissä. Otettu: byjus.com
- Esimerkkien tietosanakirja (2017). Alkynit. Palautettu: Esimerkkejä.yhteistyö
- Kevin a. Boudreaux. Alkynit. Otettu: Angelo.Edu
- Robert C. Neuman, Jr. Alkeenit ja alkynit. [PDF]. Otettu: Chem.Ucr.Edu

